ответ: 2,24 л
Объяснение:
NaHCO3 + HCl = NaCl + H2O + CO2↑
m(HCl) = 7,3г
M(HCl) = 36,5 г/моль
m(NaHCO3) = 8,4г
M(NaHCO3) = 84 г/моль
Vм = 22,4 л/моль- постоянное число, молярный объём
n(HCl) = m/M = 0,2 моль
n(NaHCO3) = m/M = 0,1 моль
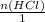 = 0,2 >
= 0,2 > 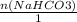 = 0,1 моль
= 0,1 моль
значит, считаем по NaHCO3
n(CO2) = n(NaHCO3) = 0,1 моль
V(CO2) = n*Vм = 0,1 * 22,4 = 2,24 л
Если даны массы нескольких исходных веществ, то расчет по уравнению реакции проводят по тому из веществ, которое находится в недостатке, т.е. первым заканчивается в реакции.
Для того, чтобы узнать, какое из веществ находится в недостатке, сравнивают их относительные количества, т.е. количества, деленные на соответствующие коэффициенты в уравнении реакции.
1. AlCl3- хлорид алюминия
Аl +3, Cl -1
MgS- сульфид магния
Mg +2, S -2
SO3- оксид серы (6)
S +6, O -2
N2O5- оксид азота (5)
N +5, O -2
2.N3H - аммиак, HCl соляная кислота, SiO2 - оксид кремния, SO - оксид серы (2)
3.а) замещение слож. вещ. CuO CO2
б) замещение слож. вещ. H2O Fe3O4
в) соединение слож. вещ. Al2O3
г) разложение слож. вещ. KNO3 KNO2
4.2Fe(OH)3= Fe2O3 + 3H2O
3Ba(NO3)2 + Fe2(SO4)3=3BaSO4 + 2Fe(NO3)3
2Al + 3H2SO4= Al2(SO4)3 + 3H2
P2O5 + 3H2O=2H3PO4
5.а) 27*2+16*3 =102 г/моль
б) 14*2+ 16*3=76 г/моль
в) 39+14+16*2=85 г/моль
6.Mr(H2O)=18 г/моль
n(H2O)=360/18 = 20моль
вроде так)