Немного теории для начала.
Массовую долю элемента в веществе рассчитывают по формуле:
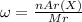 (*), здесь
(*), здесь 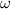 - массовая доля, nAr(x) - атомная масса элемента, n - когда в веществе присутствует несколько атомов данного элемента, например H2SO4 - тут два водорода, значит будет - 2Ar(H), ну и Mr - молекулярная масса вещества, ее рассчитывают с периодической системы, складывая атомные массы, учитывая количество атомов элемента в веществе. Ну и для Mg(OH)2
- массовая доля, nAr(x) - атомная масса элемента, n - когда в веществе присутствует несколько атомов данного элемента, например H2SO4 - тут два водорода, значит будет - 2Ar(H), ну и Mr - молекулярная масса вещества, ее рассчитывают с периодической системы, складывая атомные массы, учитывая количество атомов элемента в веществе. Ну и для Mg(OH)2
- Считаем молекулярну массу:
Mr(Mg(OH)2) = Ar(Mg) + 2Ar(O) + 2Ar(H) = 24 + 32 + 2 = 58
- Теперь подставляем данные в формулу (*):
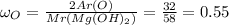 если в процентах, то
если в процентах, то
55%
1. Fe не расплавится в пламени спиртовки т.к. Т пламени спиртовки около 900°С, а температура плавления железа 2536°С
2. FeO (II), Fe2O3 (III), Fe3O4 - железная окалина (смесь оксидов FeO * Fe2O3)
3.FeO-основный оксид,
лектронная конфигурация ионов Fe3+ - 1s22s22p63s23p63d54s0
А) Fe+HCl = 2FeCl2 + H2
Б) Fe + Br2 = FeBr2
Fe(0) --- Fe(2+) |2|1 - восстановитель
3Br(0) --- 2Br(-) |2|1 - окислитель
В) 3Fe + 2O2 = Fe3O4
3.
Fe2O3 + 3H2 → 2Fe + 3H2O
n(Fe2O3) = 1600 г/160 г/моль=10 моль
По УХР видно, что железа в два раза больше, чем Железняка, т.е. n(Fe)=10 моль * 2 = 20 моль
m(Fe)=20 моль + 56г/моль =1120 г.
1120 г -- 100%
Х г -- 70%
Х = 1120*70%/100%=784 г
ответ: m(Fe) = 784 г
Вот так правильно:
S¯² – 8ē ⟶ S⁺⁶ | ×1 окисление, H₂S — восстановитель
Cl₂⁰ + 2ē ⟶ 2Cl¯¹ | ×4 восстановление, Cl₂ — окислитель
——————————————
H₂S + 4Cl₂ + 4H₂O ⟹ H₂SO₄ + 8HCl.
Если есть дополнительные вопросы, обращайтесь в контакте Yury Euler.