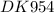Объяснение:
Заполнение электронами орбиталей в атоме происходит по правилу Клечковского: в порядке возрастания суммы главного (n) и орбитального (l) квантовых чисел. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
Для орбитали 4d n = 4, l = 2; n + l = 6
Для орбитали 5s n = 5, l = 0; n + l = 5
Значит 5s заполнится раньше, чем 4d.
Для орбитали 6s n = 6, l = 0; n + l = 6
Для орбитали 5p n = 5, l = 1; n + l = 6
Значит 5p заполнится раньше, чем 6s.
43Tc 1s22s22p63s23p63d104s24p64d55s2.
1)Вычислить относительную плотность оксида серы 4 по азоту.
M(SO₂)=64г./моль
M(N₂)=28г./моль
D(N₂)=M(SO₂)÷M(N₂)=64г./моль÷28г./моль=2,285
2) рассчитайте объём метана при нормальны условиях количеством 4,5 моль
V(CH₄)=n(CH₄)xVm=4,5 мольx22,4л./моль=100,8л.
3) вычислить какое количество вещества составляют 30,1*10^23 молекул оксида углерода (2)
n(CO₂)=N(CO₂)÷Na
n(CO₂)=30,1·10²³молекул÷6,02·10²³молекул/моль=5моль
4) вычислить массу и количество кислорода прореагировавшего с кремнием, если известно, что образовалось 10г. Оксида кремния (4)
Дано:
m(SiO₂)=10г.
Vm=22,4л./моль
m(O₂)-? n₁(O₂)-?
1.M(SiO₂)=28+32=60г./моль
2.n₁(SiO₂)=m(SiO₂)÷M(SiO₂)=10г.÷60г./моль=0,16моль
3.Si + O₂=SiO₂
по уравнению реакции:
n(SiO₂)=n(O₂)=1моль
по условию задачи:
n₁(SiO₂)=n₁(O₂)=0,16моль
4. M(O₂)=32г./моль
5. m(O₂)=n₁(O₂)xM(O₂)=0,16мольх32г./моль=5,12г.
6. V(O₂)=n₁(O₂)xVm=0,16мольх22,4л./моль=3,584л.
7. ответ: если образовалось 10г. оксида кремния(IV) то в реакцию вступил кислород количеством вещества 0,16моль, массой 5,12г. или объемом 3,584л.
Дано:
m(Al₂O₃) = 20,4 гр
η(соли) = 90%
Найти:
m прак.(соли) - ?
1) Для начала мы запишем уравнение реакций то что известно по условию, именно по такой уравнений реакций мы будем пользоваться:
Al₂O₃ + 2NaOH → 2NaAlO₂ + H₂O
2) Далее мы находим количества вещества у оксида алюминия, а потом у образовавшейся соли из уравнения реакций:
M(Al₂O₃) = 27×2 + 16×3 = 54 + 48 = 102 гр/моль
n(Al₂O₃) = m(Al₂O₃)/M(Al₂O₃) = 20,4 гр / 102 гр/моль = 0,2 моль ⇒ n(NaAlO₂) = 2n(Al₂O₃) = 2×0,2 моль = 0,4 моль
3) Теперь находим теоретическую массу соли:
M(NaAlO₂) = 23 + 27 + 16×2 = 50 + 32 = 82 гр/моль
m теор.(NaAlO₂) = n(NaAlO₂)×M(NaAlO₂) = 0,4 моль × 82 гр/моль = 32,8 гр
4) Далее находим практическую массу соли:
η(соли) = m прак.(NaAlO₂) / m теор.(NaAlO₂) × 100% ⇒
m прак.(NaAlO₂) = (m теор.(NaAlO₂) × η(соли))/100% = (32,8 гр × 90%)/100% = 32,8 гр × 0,9 = 29,52 гр
ответ: m прак.(NaAlO₂) = 29,52 гр
Решено от :