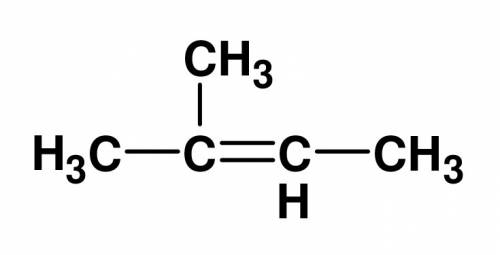
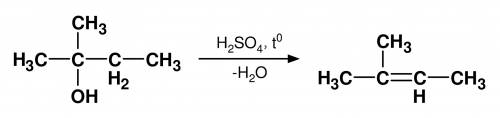
Дано:
m₁(р-ра)=250г.
ω₁%=4%
m₁(соли)=10г.
ω₂%-?
1. Определяем массу соли в 250г. 4% раствора:
m₂(соли)= ω%×m(р-ра)÷100%=4%×250г.÷100%=10г.
2. Находим массу воды: m(H₂O)= m₁(р-ра)-m₂(в-ва)= 250г.-10г.=240г
3. Находим общую массу соли: m(соли)=m₁(соли)+m₂(соли)=10г.+10г.=20г.
4. Находим массу нового раствора:
m₂(р-ра)=m(H₂O)+m(соли)=240г.+20г.=260г.
5. Находим массовую долю соли вновь полученного раствора:
ω%=m(соли)÷m₂(р-ра)×100%=20г.÷260г..×100%=7,7 %
6. ответ при добавлении 10г. соли к 250г. с массовой долей соли 4% получим новый раствор с массовой долей 7,7%
2 - в
3 - А
4 - Б
5 - Б
6 - Б
7 - Б
8 - В
9 - В
10 - В