Правило "рычага" для растворов (вывод ищите в учебниках по физической химии, раздел "Фазовые равновесия" двухкомпонентных систем):
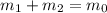
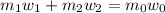
Концентрацию второго раствора находим из соотношений молярных масс соли и кристаллогидрата:
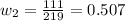
Концентрация соли в воде, очевидно, равна нулю. Следовательно, масса второго раствора будет равна:
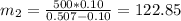 г.
г.
Масса чистой соли во втором растворе:
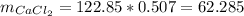 г.
г.
Количество вещества соли:
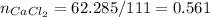 моль.
моль.
Объём второго раствора:
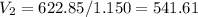 мл (0.542 л)
мл (0.542 л)
Отсюда находим молярность и нормальность раствора (фактор эквивалентности хлорида кальция равен 1/2):
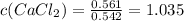 моль/л. [Молярность]
моль/л. [Молярность]
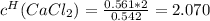 моль-экв/л. [Нормальность]
моль-экв/л. [Нормальность]