Смотри:
р-р NaCl
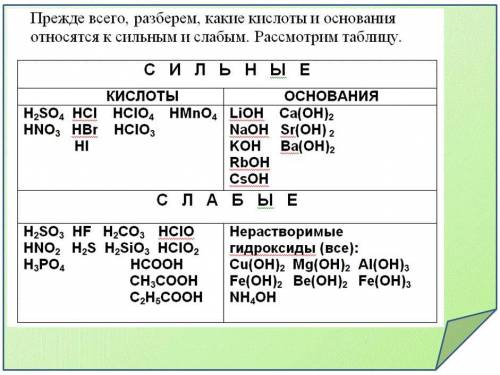
Na - ион сильного основания NaOH, Cl - ион сильной кислоты HCl, их силы приблизительно равны, следовательно среда будет нейтральная
р-р Cu(NO3)2
Cu - ион слабого основания Cu(OH)2, NO3 - ион сильной кислоты HNO3, NO3 сильнее Cu, следовательно среда будет кислая
р-р KSiO3
K - ион сильного основания KOH, SiO3 - ион слабой кислоты H2SiO3, K сильнее SiO3, следовательно среда будет щелочная
р-р Al2S3
Al - ион слабого гидроксида Al(OH)3, S - ион слабой кислоты H2S, их силы приблизительно равны, следовательно среда будет нейтральная (ионы настолько слабы, что разлагаются водой)
Відповідь:
1. Составьте формулы по валентности:
1) оксидов:
железа(III), Fe2O3
натрия, Na2O
бария, BaO
марганца(VII), Mn2O7
фосфора(V); P2O5
2) нитридов (соединений с азотом, азот пишется на втором месте, валентность Ш):
калия, K3N
магния, Mg3N2
галлия; GaN
3) гидрида кальция (соединения с водородом) CaH2
, хлорида фосфора(V), PCI5
хлорида железа (Ш) FeCI3
2.Определите валентность по формуле:
CI2O7, CI-VII O-II
MnO2, Mn-IV O-II
Mg2Si, Mg-II Si-IV
FeCI2, Fe-II CI-I
Na2S Na-I S-II
,AIN AI-III N-III
Пояснення:
Варианты ответов
• в отличие от основных гидроксидов, амфотерные гидроксиды реагируют с кислотами (неверно)
• характер гидроксида не зависит от степени окисления металла и радиуса иона (неверно)
• оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства (неверно)
• по группе сверху вниз металлические свойства s- и p-элементов усиливаются (верно)
Объяснение:
Варианты ответов
• в отличие от основных гидроксидов, амфотерные гидроксиды реагируют с кислотами
основные оксиды также реагируют с кислотами, как и большинство амфотерных.
• характер гидроксида не зависит от степени окисления металла и радиуса иона .
Степень окисления влияет на характер свойств гидроксида.
например, если она +1,+2 - гидроксиды имеют основной характер (кроме Zn, Be и др), больше +5 - кислотные, от +2,+3,+4 -в основном амфотерные.
А чем больше радиус атома, тем основные свойства ярче.
характер гидроксида зависит от степени окисления металла
• оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства
Щелочные металлы, да, проявляют основные свойства. А вот щелочно-земельные не все. Например, Be -проявляет амфотерные свойства
• по группе сверху вниз металлические свойства s- и p-элементов усиливаются
усиливаются, т.к. увеличивается радиус атомов и электроны слабее удерживаются возле него
При определении среды раствора солей необходимо учитывать, что среда раствора определяется сильным компонентом. Если соль образована кислотой, являющейся сильным электролитом, то среда раствора кислая. Если основание сильный электролит, то – щелочная.