1. Гидросульфат натрия (кислая соль натрия и серной кислоты) - NaHSO4.
Сульфат кальция (кальциевая соль серной кислоты) - CaSO4.
2. Карбонат натрия (кислая соль угольной кислоты и металл натрия) - Na2СO3.
Карбонат кальция ( кислая соль угольной кислоты с металлом кальция) - CaCO3.
3. Сульфид натрия ( соль сероводородной кислоты с натрием) - Na2S.
Сульфид кальция (соль сероводородной кислоты с кальцием) - CaS.
4. Фосфат натрия (натриевая соль ортофосфорной кислоты) - Na3PO4.
Ортофосфат кальция ( соль ортофосфатной кислоты с кальцием) - Ca3(PO4)2
1) Если концентрацию раствора выразить в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах,
ω - массовая доля растворенного вещества, выраженная в долях единицы.
5% - это 0,05 в долях единицы, а 25% - 0,25.
2) Обозначим концентрацию нового раствора через Х.
При смешении растворов массы растворенных веществ складываются .
На основании всего вышеизложенного составляем уравнение:
0,05*100 + 0,25*250 = Х*(100 + 250)
5 + 62,5 = 350Х
350Х = 67,5
Х = 0,193 ( или 19,3% ≈ 19% )
Окислительные свойства у серной кислоты выше, чем у сероводородной
Так как в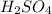 степень окисления серы +6, а в
степень окисления серы +6, а в 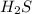 сера -2, поэтому в серной кислоте сера играет роль окислителя, а в сероводороде роль восстановителя
сера -2, поэтому в серной кислоте сера играет роль окислителя, а в сероводороде роль восстановителя
Пример: прямое взаимодействие кислот
H2SO4 - окислитель
H2S - восстановитель