Получено 19,6 г сульфата хрома (III) Cr₂(SO₄)₃ и 3,36 л водорода
Объяснение:
Дано: m(Cr) = 5,2 г; m(H₂SO₄) = 98 г.
Найти: m(Cr₂(SO₄)₃); V(H₂).
Решение.
2Cr + 3H₂SO₄ → Cr₂(SO₄)₃ + 3H₂
По уравнению реакции хром и серная кислота реагируют в отношении 2 моль : 3 моль. Найдем количество вещества в заданных массах:
Молярная масса M(Cr) = 52 г/моль
Количество вещества 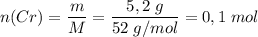 .
.
M(H₂SO₄) = 2 + 32 + 64 = 98 г/моль
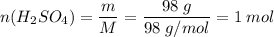
На 0,1 моль Cr требуется 0,15 моль H₂SO₄. Серная кислота дана в избытке. Расчет ведем по хрому.
По уравнению реакции
n(Cr) : n(Cr₂(SO₄)₃) : n(H₂) = 2 : 1 : 3 = 0,1 моль : 0,05 моль : 0,15 моль
Найдем массу образовавшегося сульфата хрома (III) Cr₂(SO₄)₃
M(Cr₂(SO₄)₃) = 2*52 + 32*3 + 16*4*3 = 104 + 96 + 192 = 392 г/моль
m(Cr₂(SO₄)₃) = n*M = 0,05 моль * 392 г/моль = 19,6 г.
Найдем объем выделившегося водорода:
V(H₂) = n*Va = 0,15 моль * 22,4 л/моль = 3,36 л.
Са(2+) +СО3(2-) + Н (+) + ОН(-) = НСО3 (-) + Са(2+) +ОН(-)
СО3(2-) + Н (+) = НСО3 (-)
2СаСО3 +2 Н2О = Са (НСО3)2 + Са(ОН)2 (1 ступень)
2. Na2CO3 гидролиз по аниону (по слабому)
2Nа(+) +СО3(2-) + Н (+) + ОН(-) = НСО3 (-) + 2Nа(+) +ОН(-)
СО3(2-) + Н (+) = НСО3 (-)
Na2СО3 + Н2О = NaНСО3 + NaОН (1 ступень)
3.K2SiO3 гидролиз по аниону (по слабому)
2K(+) + SiO3(2-) + Н (+) + ОН(-) = НSiO3(-) +2K(+)+ОН(-)
SiO3(2-) + Н (+) = НSiO3(-)
K2SiO3+ Н2О = КНSiO3+ КОН (1 ступень)
Надеюсь так <3