Не сложная задачка.
Уранения реакций:
HCOOC2H5 + NaOH = HCOONa + C2H5OH
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
Рассчитаем количество вещества гидроксида натрия:
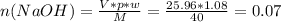 моль
моль
Пусть в реакцию вступает х моль этилового эфира муравьиной кислоты
Пусть в реакцию вступает у моль этилового эфира уксусной кислоты
Тогда, массу смеси эфиров можно математически представить как следующее выражение:
74х + 88у = 5,6 , здесь 74 - молярная массу уксусного эфира, 88 - молярная масса уксусного эфира уксусной кислоты
По уравнению реакции:
n(NaOH) = n(HCOOC2H5) = х моль
n(NaOH) = n(CH3COOC2H5) = у моль
Составим систему уравнений:
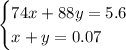
Домножим второе уравнение системы на 74, получим:
74x + 88y = 5.6
74x + 74y = 5.18
Вычтем из первого уравнения второе:
14y = 0.42
y = 0.03
х = 0,07 - 0,03 = 0,04
Рассчитаем массу уксуснометилового эфира:
m = n*M = 0,04*74 = 2,96г
Рассчитаем массу уксусноэтилового эфира:
m = n*m = 0,03*88 = 2,64г
27 г у л
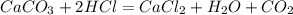
100 г 22,4 л
1.Определим чистую массу карбоната кальция в известняке:
30 г известняка - это 100%, а
х г________________90%, откуда х=30*90/100=27 г
2. По этой массе,подставив ее в уравнение реакции,и определим объем углекислоо газа:
при взаимодействии 100 г карбоната образуется 22,4 л углекислого газа, а
при --//--//-- 27 г___________________у л, откуда
у=27*22,4/100=приблизительно 6 л
Дано:
K2SO4
Найти:
ω (S в K2SO4) - ?
Массовая доля элемента в данном веществе - это отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества.
1) С периодической системы Д. И. Менделеева вычислить относительную молекулярную массу K2SO4:
Mr (K2SO4) = Ar (K) * 2 + Ar (S) + Ar (O) * 4 = 39 * 2 + 32 + 16 * 4 = 174;
2) Вычислить массовую долю S в K2SO4:
ω (S в K2SO4) = N * Ar (S) * 100% / Mr (K2SO4) = 1 * 32 * 100% / 174 = 18,39%.
ответ: Массовая доля S в K2SO4 составляет 18,39%