Для начала записываем выражение для криоскопической константы растворителя:
Ккр = (Т2 – Т1)/М,
в данном случае изменение температуры (в градусах цельсиях) равно:
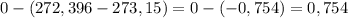 °C,
°C,
Криоскопическая константа для воды равна 1,86.
Выражаем М (моляльность раствора):
М = 0,754/1,86 = 0,4054моль на 1000 г воды.
По условию на 1000 г воды приходится 11,1*1000/100 = 111 граммов вещества, что, как ранее нами было получено, составляет 0,4054 моль.
Следовательно, 1 моль вещества весит 111/0,4054 = 273,8 г/моль ≈ 274 г/моль.
ответ: 274 г/моль
Необходимо. чтобы валентность одного из атомов в веществе была известна, иначе никак не получится.
Объяснение:
Если вы знаете валентность одного элемента, допустим у кислорода (О) в оксидах и в большинстве соединений валентность 2.
Чтобы было понятнее. разберём на примере Fe2O3.
В этом соединении нам известна валентность кислорода = 2. Умножим его валентность на количество атомов кислорода в формуле (2 х 3 = 6). 6 - это наименьшее общее кратное (НОК). Поделим теперь 6 на число атомов железа в формуле (6/2=3). Полученное число и есть валентность неизвестного элемента
m(S)=0,53*120=63,6 г
63,6/1=x/2
X=63,6*2/1=127,2
m2(S)=127,2 г
2)w(S)=Ar/Mr=96/150=0,64
m(S)=150*0,64=96
96/1=x/3
X=96*3/1=288 г
m2(S)=288 г
3)w(S)=Ar/Mr=32/80=0,64
m(S)=0,64*80=51,2 г
51,2/1=x/2,5
X=51,2*2,5/1=128 г
m2(S)=128 г
4)w(S)=Ar/Mr=96/342=0,28
m(S)=342*0,28=95,76 г
95,76/1=x/0,2
X=95,76+0,2/1=19,152 г
m2(S)=19,152 г
5)Mr(CuFeS2)=64+56+64=184 г/моль
w(S)=65/184=0,35
64,4/1=x/10
X=64,4*10/1=644 г
m(S)=184*0,35=64,4 г