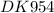Определим формулу вещества В
Пусть 100% = 100г, тогда имеем
m(C) = 83,27г и m(H) = 16,71г
n(C) : n(H) = 83,27г / 12г/моль : 16,71г / 1г/моль = 1 : 2
CH2 - простейшая формула углеводорода
Mr(В) = 43 * 2 = 86 г/моль
Mr(B) / Mr(B) = 86 / 14 = 6
По реакция ясно то, что вещество B - алкан, тогда искомый продукт имеет формулу C6H14
Заметим, что вещество А - алкен, а вещество Б - бромид алкана, тогда реакция Б → В - реакция Вюрца (удвоение цепи)
CH2=CH-CH3 (Вещество А) + HBr => CH3-CH2Br-CH3 (Вещество Б)
2CH3-CH2Br-CH3 + 2Na => CH3 - CH2(CH3-CH-CH3) - CH3 (Вещество В)
(CH2 - под ним CH, а слева и справа по CH3)
Дано:
T = 293 К
[Ca²⁺] = 70 моль/л
Найти:
E(Ca²⁺/Ca) - ?
Для нахождения активности ионов металла в растворе единице для определения величины электродного потенциала используется уравнение Нернста, именно по такой формуле мы найдем потенциал кальциевого электрода:
E°(Ca²⁺/Ca) = -2,87 В - из табличного значения про "Стандартные электродные потенциалы"
F = 96500 Кл/моль - Число Фарадея
R = 8,31 Дж/(моль×К) - Универсальная газовая постоянная
n = 2 - Валентность иона кальция
E(Ca²⁺/Ca) = -2,87 В + (8,31 Дж/(моль×К) × 293 К) / (2 × 96500 Кл/моль) × lg 70 = -2,87 В + (2434,83 Дж/моль) / (193000 Кл/моль) × lg(10×7) ≈ -2,87 В + 0,0126 Дж/Кл × (lg 10 + lg 7) ≈ -2,87 В + 0,0126 В × (1 + 0,845) ≈ -2,87 В + 0,0126 В × 1,845 ≈ - 2,87 В + 0,0233 В ≈ -2,8467 В ≈ -2,85 В
ответ: E(Ca²⁺/Ca) = -2,85 В
Решено от :