
K2CO3 + Al2O3 → 2 KAlO2 + CO2↑ (реакция 1)
1121
n=m/M
n(Al2O3) = 5,1 / 102 = 0,05 моль
n(K2CO3) = 12,5 / 138 = 0,09 моль - избыток
=> n(KAlO2) = 0,05 ∙ 2 = 0,1 моль, n(CO2) = 0,05 моль
KAlO2 + 4 HNO3 → KNO3 + Al(NO3)3 + 2 H2O (реакция 2)
14
Кроме того, избыток 0,09 - 0,05 = 0,04 моль K2CO3 реагирует с кислотой:
K2CO3 + 2 HNO3 → 2 КNO3 + СО2↑ + Н2О (реакция 3)
121
n (HNO3, реаг.) = 0,1 ∙ 4 + 0,04 ∙ 2 = 0,48 моль
m (HNO3, реаг.) = n ∙ М = 0,48 ∙ 63 = 30,24 г
m (HNO3, исх.) = V ∙ ω ∙ ρ = 200 ∙ 0,15 ∙ 1,05 = 31,5 г
m (HNO3, изб.) = 31,5 - 30,24 = 1,26 г
По з-ну сохр-я вещ-ва, масса полученного в рез. трех реакций р-ра равна массе исх. вещ-в за вычетом образованного СО2↑ (принимая, что он полностью выделился из раствора):
m(получ. р-ра)= m(K2CO3) + m(Al2O3) + m(р-ра HNO3) - m(СО2)
В р. 1 образовались n(CO2) = 0,05 моль, в р. 3 еще 0,04 моль, всего 0,09 моль СО2.
m(СО2) = n(СО2) ∙ М(СО2)
m(р-ра HNO3) = V(р-ра) ∙ ρ
m(получ. р-ра)= 12,5 + 5,1 + 200 ∙ 1,05 - 0,09 ∙ 44 = 223,64 г
ω% (HNO3) = m (HNO3, изб.) ∙ 100 / m (получ. р-ра) = 1,26 г ∙ 100 / 223,64 г = 0,56%
Объяснение:
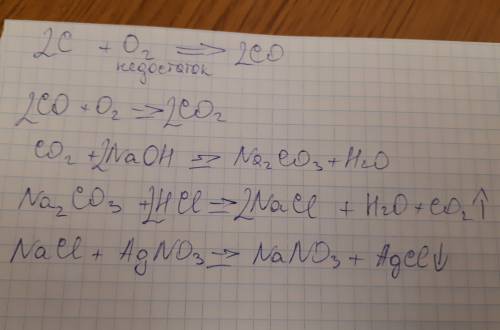
1. cероводород →1→ сера →2→ сернистый газ →3→ оксид серы(VI) →4→ серная кислота
1) H2S → S + H2
H2S является восстановителем, H2S является окислителем
2) S + O2 → SO2
S является восстановителем, O2 является окислителем
3) 2 SO2 + O2 → 2 SO3
SO2 является восстановителем, O2 является окислителем
4) SO3 + H2O → H2SO4
3. Сульфат с одновалентным металом: Na2(SO4) - Сульфат натрия
Сульфат с двухвалентным металом: Ca(SO4) - Сульфат кальция
Сульфат с трёхвалентным металом: Аl(SO4) - Сульфат алюминия
Гидросульфат с одновалентным металом: NaHSO4 - Гидросульфат натрия
Гидросульфат с двухвалентным металом: Вa(HSO4)2- гидросульфат бария