ответ следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. Можно привести строение атомов углерода С, азота N, кислорода О, фтора F. Это позволит сделать вывод о том, что по мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.
Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей. Приведем примеры.
Можно добавить, что некоторые неметаллы могут реагировать и со сложными веществами (оксидами, кислотами, солями). Следующие уравнения учащийся приводит по желанию:
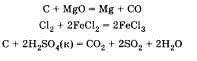
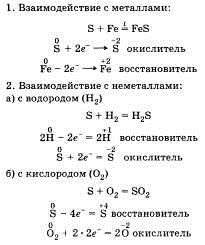

3Mg + N2 -> Mg3N2
Продукт реакции - нитрид магния.
Тип химической связи - ионная.
Кристаллическая решетка - ионная.
С расставленными степенями окисления:
3Mg(0) + N2(0) -> Mg3(+2)N2(-3)
Mg(0)--(-2ē)-->Mg(+2) | 2 | ×3
- восстановитель(отдает электроны), процесс окисления
N2(0)--(+6ē)-->2N(-3) | 6 | ×1
- окислитель(получает электроны), процесс восстановления.
Нитрид магния реагирует с водой:
Mg3N2 + 6H2O -> 3Mg(OH)2 + 2NH3
3Ca + N2 -> Ca3N2
Продукт реакции - нитрид кальция.
Тип химической связи - ионная.
Кристаллическая решетка - ионная.
С расставленными степенями окисления:
3Ca(0) + N2(0) -> Ca3(+2)N2(-3)
Ca(0)--(-2ē)-->Ca(+2) | 2 | ×3
- восстановитель(отдает электроны), процесс окисления
N2(0)--(+6ē)-->2N(-3) | 6 | ×1
- окислитель(получает электроны), процесс восстановления.
Нитрид кальция реагирует с водой:
Ca3N2 + 6H2O -> 3Ca(OH)2 + 2NH3
2Al + N2 -> 2AlN
Продукт реакции - нитрид алюминия.
Тип химической связи - ионная.
Кристаллическая решетка - ионная.
С расставленными степенями окисления:
2Al(0) + N2(0) -> 2Al(+3)N(-3)
Al(0)--(-3ē)-->Al(+3) | 3 | ×2
- восстановитель(отдает электроны), процесс окисления
N2(0)--(+6ē)-->2N(-3) | 6 | ×1
- окислитель(получает электроны), процесс восстановления.
Нитрид алюминия взаимодействует с водой:
AlN + 3H2O -> Al(OH)3 + NH3
Из хим. свойств нитридов данных металлов, можно увидеть сходную реакцию на воду. Во всех случаях происходит образование основания и газа - аммиака.
У нитридов магния, кальция преобладают основные свойства, нитрид алюминия же является амфотерным.
Вот
Объяснение: