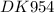при добавлении к гидроксиду аммония индикатора фенолфталеина, цвет раствора приобретает малиновую окраску,т.к. среда раствора щелочная.
уравнение диссоциации:
NH₄OH ⇔ NH₄⁺ + OH⁻
уравнение константы диссоциации:
Kd = [NH₄⁺] [OH⁻]\[NH₄OH] = 1,76·10⁻⁵
при добавлении хлорида аммония, который является хорошо диссоциирующей солью, NH₄Cl ↔NH₄⁺ + Cl⁻
следовательно добавится количество ионов NH⁺ и равновесие сдвинется влево. Диссоциация гидроксида аммония будет подавляться и раствор будет иметь менее интенсивную окраску, за счет меньшего числа ОН⁻-анионов.
Привет! Сейчас решим
1) Гашенная известь нашла применение в строительстве, как вяжущий материал, который используется при создании каменной кладки, во время штукатурных работ, а также для побелки стен и потолков.
2) По большей части сталактиты и сталагмиты состоят из отложений карбоната кальция, который получается в ходе превращения Ca(OH)2 + CO2 = CaCO3 + H2O. По такой же схеме происходит превращение растворенных солей кальция и магния в питьевой воде, в нерастворимые, которые образуют накипь. Это объединяет накипь со сталактитами и сталагмитами
Готово! Есть вопросы? Пиши и я отвечу
1. H⁺¹Br⁻¹ + H₂⁺¹S⁺⁶O₄⁻² → Br₂⁰ + S⁺⁴O₂⁻² + H₂⁺¹O⁻²
2Br⁻¹ - 2e⁻ → Br₂⁰ | 2 | | 1 | - восстановитель - окисление
| | 2 | |
S⁺⁶ + 2e⁻ → S⁺⁴ | 2 | | 1 | - окислитель - восстановление
В итоге получаем:
2HBr + H₂SO₄ → Br₂ + SO₂ + 2H₂O
2. K⁺¹Cl⁺¹O⁻² → K⁺¹Cl⁺⁵O₃⁻² + K⁺¹Cl⁻¹
Cl⁺¹ - 4e⁻ → Cl⁺⁵ | 4 | | 1 | - восстановитель - окисление
| | 4 | |
Cl⁺¹ + 2e⁻ → Cl⁻¹ | 2 | | 2 | - окислитель - восстановление
В итоге получаем:
3KClO → KClO₃ + 2KCl
3. Na₂⁺¹S⁺⁴O₃⁻² → Na₂⁺¹S⁻² + Na₂⁺¹S⁺⁶O₄⁻²
S⁺⁴ + 6e⁻ → S⁻² | 6 | | 1 | - окислитель - восстановление
| | 6 | |
S⁺⁴ - 2e⁻ → S⁺⁶ | 2 | | 3 | - восстановитель - окисление
В итоге получаем:
4Na₂SO₃ → Na₂S + 3Na₂SO₄
4. K⁺¹Cl⁻¹ + K⁺¹Mn⁺⁷O₄⁻² + H₂⁺¹S⁺⁶O₄⁻² → Cl₂⁰ + K₂⁺¹S⁺⁶O₄⁻² + Mn⁺²S⁺⁶O₄⁻² + H₂⁺¹O⁻²
2Cl⁻¹ - 2e⁻ → Cl₂⁰ | 2 | | 5 | - восстановитель - окисление
| | 10 | |
Mn⁺⁷ + 5e⁻ → Mn⁺² | 5 | | 2 | - окислитель - восстановление
В итоге получаем:
10KCl + 2KMnO₄ + 8H₂SO₄ → 5Cl₂ + 6K₂SO₄ + 2MnSO₄ + 8H₂O
5. Zn⁰ + H⁺¹N⁺⁵O₃⁻² → Zn⁺²(N⁺⁵O₃⁻²)₂⁻¹ + N₂⁺¹O⁻² + H₂⁺¹O⁻²
Zn⁰ - 2e⁻ → Zn⁺² | 2 | | 4 | - восстановитель - окисление
| | 8 | |
2N⁺⁵ + 8e⁻ → N₂⁺¹ | 8 | | 1 | - окислитель - восстановление
В итоге получаем:
4Zn + 10HNO₃ → 4Zn(NO₃)₂ + N₂O + 5H₂O
Решено от :