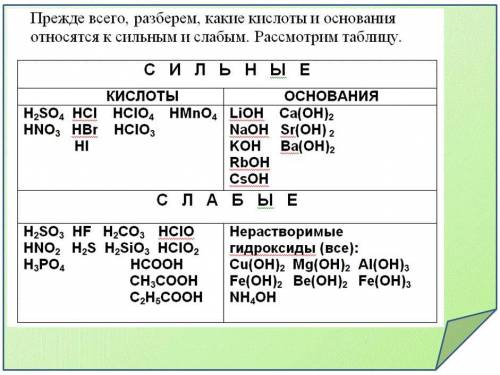
Смотри:
р-р NaCl
Na - ион сильного основания NaOH, Cl - ион сильной кислоты HCl, их силы приблизительно равны, следовательно среда будет нейтральная
р-р Cu(NO3)2
Cu - ион слабого основания Cu(OH)2, NO3 - ион сильной кислоты HNO3, NO3 сильнее Cu, следовательно среда будет кислая
р-р KSiO3
K - ион сильного основания KOH, SiO3 - ион слабой кислоты H2SiO3, K сильнее SiO3, следовательно среда будет щелочная
р-р Al2S3
Al - ион слабого гидроксида Al(OH)3, S - ион слабой кислоты H2S, их силы приблизительно равны, следовательно среда будет нейтральная (ионы настолько слабы, что разлагаются водой)
1) 8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
2) 4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
3) C + 2H2SO4(конц.) → CO2↑ + 2H2O + 2SO2↑
4) Cu + 2H2SO4(конц.) → CuSO4 + 2H2O + SO2↑
5) 2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2
6) 2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
7) 3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
8) 8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
9) B + H2SO4(конц) → H3BO3 + S Нельзя уравнять. Скорее всего не S, а SO2:
2B + 3H2SO4(конц) → 2H3BO3 + 3SO2
10) 2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
11) 2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑
12) S + 2H2SO4(конц.) → CO2↑ + 2H2O + 3SO2↑
Объяснение:
Окислители выделены жирным
Восстановители подчёркнуты
2 а)
3 в)
4 а)
5 в) г)
6 а) б)
7 а) г)
8 в) а)
9 Mg+H2SO4->MgSO4+H2
SO3+HCl->ClSO2OH
SO2+2NaOH->Na2SO3+H2O
10)3Cu+8HNO3(розб)->2NO+3Cu(NO3)2+4H2O
Cu(0)-2e=Cu(2+). 3
N(5+)+3e=N(2+). 2
11)а)
Na2CO3+2HNO3->2NaNO3+CO2+H2O
2Na(+)+CO3(2-)+2H(+)+2NO3(-)->2Na(+)+2NO3(-)+CO2+H2O
2H(+)+CO3(2-)=H2CO3=CO2+H2O
б)Реакция не идет
12) Mg+H2SO4->MgSO4+H2
m(Mg)=4,8 г
V(H2)=?
n(Mg)=4,8/24=0,2 моль
n(Mg)=n(H2)
V(H2)=0,2*22,4=4,48 л
13.S+O2->SO2
2SO2+O2->2SO3
SO3+2NaOH->Na2SO4+H2O
Na2SO4+BaCl2->BaSO4+2NaCl
1)Сера
2)Диоксид серы
3)Оксид серы(6)
4)Сульфат натрия
5)Сульфат бария