А.1. Взаимодействие оксида кальция с водой относится к реакции А.2. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно
А.3. Состояние химического равновесия характеризуется
А.4. Среди следующих веществ неэлектролитом является
А.5. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
А.6. Гидролиз соли можно усилить, если:
А.7. Гидролиз какой соли идет по катиону?
А.8. Найдите окислительно-восстановительную реакцию среди предложенных уравнений:
А.9. Простое вещество с наиболее ярко выраженными металлическими свойствами:
А.10. Металлы из руд с электролиза получить:
А.11. При электролизе хлорида калия на катоде ( - электроде) выделяется
А.12. Раствор соляной кислоты реагирует с каждым из двух ве¬ществ:
А.13. Раствор сульфата меди (II) не реагирует с:
В.1. Неверным является утверждение, что получение аммиака из азота – это процесс:
а) разложения;
В.2. Оцените справедливость суждений о скорости химических реакций. В.2 - б
В.3. Соль, образованная сильным основанием и сильной кислотой гидролизуется по…( катиону; аниону; и по катиону и по аниону; не подвергается гидролизу). Нужное подчеркнуть.
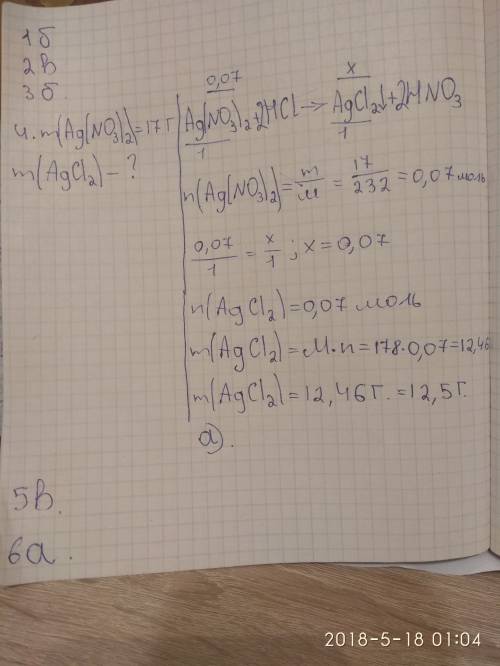
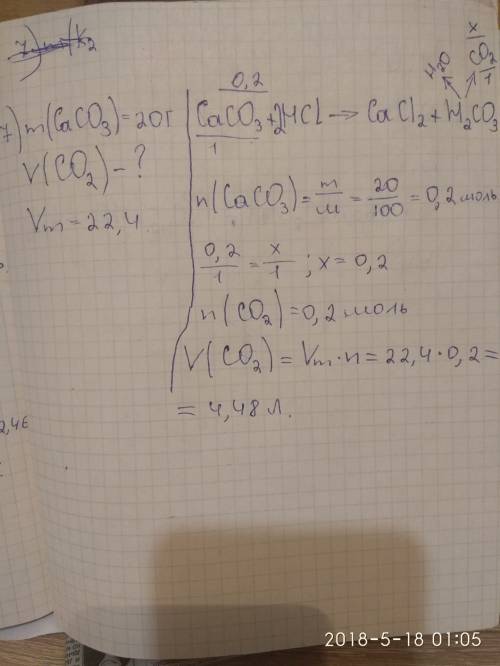
б) Ba + 2H2O = Ba (OH)2 + H2
2. Укажіть пару солей, в якій обидві солі нерозчинні:
в) AgCl, BaSO4.
3. Дано рівняння реакції:
Cu + 2AgNO3 Cu(NO3)2 + 2Ag
Ця реакція можлива, тому що:
б) більш активний метал витісняє з розчину солі менш активного металу;
4. У результаті взаємодії аргентум(І) нітрату масою 17 г із хлоридною кислотою випадає осад масою:
Дано:
m(AgNO3)=17 r
Знайти:
m(AgCl)-?
M(AgNO3)= 170 г/моль
n(AgNO3) = m/M = 17г/170 г/моль =0,1 моль
M(AgCl) = 143.5 г/моль
AgNO3 + HCl = AgCl + HNO3
З рівняння реакції бачимо, що n(AgCl)=n(AgNO3)= 0,1 моль
m(AgCl) = n*M = 0,1 моль*143,5 г/моль = 14,35 г
в) 14,35 г.
5. Унаслідок сильного нагрівання нерозчинних у воді основ утворюються:
в) оксид і вода.
6. Гідроксиди складу Ме(ОН)3 утворюються металами:
а) Аl, Fe, Сr;
7. Який об'єм газу (н. у.) виділиться в результаті остаточного розчинення кальцій карбонату масою 20 г у хлоридній кислоті?
Дано:
m(CaCO3)= 20 r
Знайти:
V(CO2)-?
n(CaCO3)= m/M = 20 г/100 г/моль = 0,2 моль
СaCO3 + 2HCl = CaCl2 + H2O + CO2
З реакції бачимо, що n(CO2)=n(CaCO3) = 0,2 моль
V(CO2) = n*Vm = 0,2 моль*22,4 л/моль = 4,48 л
Відповідь,4,48 л
8. Здійсніть перетворення:
Ca → CaO → Ca (OH)2 → Ca3 (PO4)2 → Сa (NO3)2
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Ca3(PO4)2 + 3Ba(NO3)2 = 3Ca(NO3)2 + Ba3(PO4)2↓
9. Складіть рівняння хімічних реакцій послідовних перетворень для одержання ортофосфатної кислоти з фосфору.
4P+5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
10. Двовалентний метал масою 1,2 г без залишку розчинився в хлоридній кислоті. При цьому витратилася кислота масою 3,65 г. Визначте цей елемент.
Дано:
m(Me)=1,2 г
m(HCl) = 3,65 г
Знайти:
Ме-?
M(HCl) = 36,5 г/моль
n(HCl) = m/M = 3,65 г/36,5 г/моль = 0,1 моль
Мe + 2HCl = MeCl2 + H2
З рівняння реакції бачимо,що n(Me) = 0,5n(HCl)
n(Me) = 0,5*0,1 моль = 0,05 моль
М(Ме) = m/n = 1,2 г/0,05 моль = 24 г/моль ⇒ Mg
Відповідь: Mg