Объяснение:
Шаг первый.
Доля углерода w(C) = 12*n(колво ат С) / M(в-ва)
M(в-ва)=12*n/0.55
Перебор даёт следующие целые числа n=11 и M=240 (идеально подходит)
Далее, подозреваю, автор вопроса ошиблась и не правильно написала долю азота. Скорее всего, имелось в ввиду 11,7% (два атома азота) так как аналогичная постановка для азота не даёт разумных целых чисел.
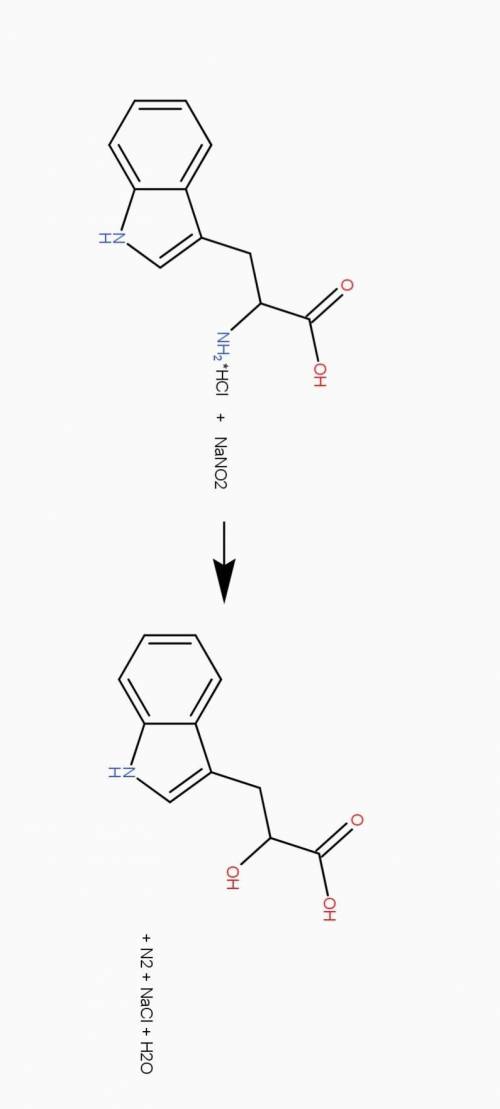
Таким образом, мы имеем - C11HxN2....логично здесь предположить наличие кислорода.
В состав живых организмов входят азотистые основания и аминокислоты. С 11 атома и углерода и 2 азота есть триптофан. С11Н12N2O2 однако, его масса - на 36 меньше найденной (240). Однако, триптофан легко образует соли и его соль с HCl идеально подходит.
(тут следует посетовать на неточность в задании. Да, триптофан действительно не очень растворимый в воде, но вот его гидрохлорид - отлично)
Объяснение:
Поводом для введения контрреформ стало убийство царя Александра II. Вступивший на престол Александр III озаботился усилением со стороны революционных сил и очень осторожно выбирал пути своего нового курса. Выбор сделать сторонники реакционной идеологии К. Победоносцев и Д. Толстой. Приоритетами стали сохранение самодержавия, укрепление сословного строя, традиций и основ российского общества и неприятие либеральных преобразований. Еще одной причиной контрреформ стало то, что власть не была готова к быстрому развитию и изменениям. А эти изменения уже начались: усилилось имущественное неравенство в деревне, возросло количество пролетариата. Власть не всегда понимала проходящие процессы и мыслила старыми понятиями. Император прислушался к рекомендациям Победоносцева и отправил в отставку главного либерала М. Лорис-Меликова, поскольку не согласился с его планом преобразований. В результате была создана программа нового царствования, которая была изложена 29 апреля 1881 года в Манифесте о незыблемости самодержавия. Автором манифеста стал К. Победоносцев.
Рэакцыя нейтралізацыі - кіслаты з асновай рэакцыя ўзаемадзеяння . У выніку якой утвараюцца сталь і вада адзін з тыпаў кіслотна-асноўных рэакцый . Любая рэакцыя нейтралізацыі зводзіцца да ўзаемадзеяння іёнаў Н i OH 3 адукацыяй слабадысацыяванага электраліта H 2
прыклад:
HCI + NaOH = NaCl + H O 2
У іённай форме ўраўненне запісваецца так:
H + OH = 4 O. 2
Раствор становіцца нейтральным, калі выкарыстоўваюцца моцныя кіслоты і
шчолачы.