Нитрат свинца (II), соль образована слабым основанием Pb(OH)₂и сильной кислотой HNO₃, гидролиз пойдет по катиону(Pb²⁺):
Pb(NO₃)₂+H-OH⇄Pb(OH)NO₃+HNO₃
Pb²⁺+2NO₃⁻+H-OH⇄Pb(OH)⁻+NO₃⁻+H⁺+NO₃⁻
Pb²⁺++H-OH⇄Pb(OH)⁻+H⁺
Среда раствора кислая (pH < 7)
Фосфат калия, соль образована сильным основанием KOH и слабой кислотой H₃PO₄, гидролиз пойдет по аниону(PO₄³⁻):
K₃PO₄+H-OH⇄K₂HPO₄+KOH
3K⁺+PO₄³⁻+H-OH⇄2K⁺+HPO₄²⁻+K⁺+OH⁻
PO₄³⁻+H-OH⇄HPO₄²⁻+OH⁻
Среда раствора щелочная (pH > 7 )
Сульфат цинка, соль образована слабым основанием Zn(OH)₂ и сильной кислотой H₂SO₄, гидролиз пойдет по катиону(Zn²⁺):
2ZnSO₄+2H-OH⇄(ZnOH)₂SO₄+H₂SO₄
2Zn²⁺+2SO₄²⁻+H-OH⇄2(ZnOH)₂⁺+SO₄²⁻+2H⁺+SO₄²⁻
2Zn²⁺+2SO₄²⁻+H-OH⇄2(ZnOH)₂⁺+2H⁺
Среда раствора кислая (pH < 7)
Хлорид бария BaCI₂, соль образована сильным основанием Ba(OH)₂и сильной кислотой HCI, такие соли просто растворяются в воде, диссоциируют :
BaCI₂⇄Ba²⁺+2OH⁻
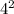 -+молекула воды.Б. 1. Mg(OH)2+H2SO4=Mgso4+2H20. OH-+H+=молекула воды. 2. Mg (OH2)+SO3=MgSO4+МОЛЕКУЛА ВОДЫ. SO3+2OH-=МОЛЕКУЛА ВОДЫ+SO2-4. 3. H2SO4+NA2O=NA2SO4+H2O/ NA20+2H+=2NA+ =H2O.
-+молекула воды.Б. 1. Mg(OH)2+H2SO4=Mgso4+2H20. OH-+H+=молекула воды. 2. Mg (OH2)+SO3=MgSO4+МОЛЕКУЛА ВОДЫ. SO3+2OH-=МОЛЕКУЛА ВОДЫ+SO2-4. 3. H2SO4+NA2O=NA2SO4+H2O/ NA20+2H+=2NA+ =H2O.
Для решения задачи необходимо знать уравнение реакции между оксидом кремния (SiO2) и гидроксидом натрия (NaOH), которое выглядит следующим образом:
SiO2 + 2NaOH → Na2SiO3 + H2O
Из уравнения видно, что 1 моль оксида кремния реагирует с 2 молями гидроксида натрия, образуя 1 моль силиката натрия и 1 моль воды. Молярная масса оксида кремния (SiO2) составляет 60 г/моль, а молярная масса гидроксида натрия (NaOH) равна 40 г/моль.
Сначала необходимо вычислить количество молей оксида кремния в реакции:
n(SiO2) = m(SiO2) / M(SiO2) = 30 г / 60 г/моль = 0.5 моль
Затем вычисляем количество молей гидроксида натрия, необходимое для реакции с 0,5 молью оксида кремния:
n(NaOH) = n(SiO2) × 2 = 1 моль
Теперь можно вычислить массу гидроксида натрия, участвующего в реакции:
m(NaOH) = n(NaOH) × M(NaOH) = 1 моль × 40 г/моль = 40 г
Наконец, вычисляем массу силиката натрия:
m(Na2SiO3) = n(Na2SiO3) × M(Na2SiO3) = 1 моль × 122 г/моль = 122 г
Таким образом, масса силиката натрия, образованного в реакции, составляет 122 г.
Объяснение: