67, 2 л Н2
Объяснение:
На фото
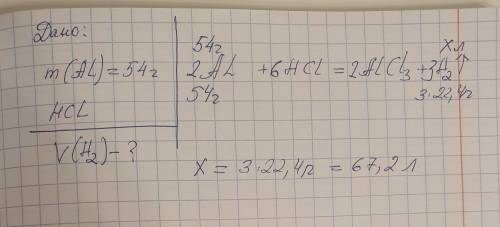
при взаимодействии двух оксидов один обязательно должен проявлять основные свойства ( т.е. быть оксидом металла) , второй -кислотные свойства ( быть оксидом НЕметалла)
схема: МеО + НеМЕО =соль
что такое соль? это Ме( кислотный остаток)
Ме берется из основного оксида( у нас это кальций Ca)
кислотный остаток - берется из соответствующей кислоты ,которую образует кислотный оксид
у нас кислотный оксид - N2O5 ему соответствует азотная кислота -HNO3 , кислотный остаток в кислоте - (NO3), вот и составляем соль с учетом валентности Ca(NO3)2
ЗАКРЕПИМ Na2O и SO3
Na2O основнй оксид,значит берем металл Na
SO3 кислотный оксид, значит нужна соответствующая кислота и ее кислотный остаток
SO3 + H2O = H2SO4
соединяем с учетом валентности и получаем: Na2SO4
1.
Гальванический элемент представляет собой систему из двух электродов, погруженных в раствор своих солей.
При выборе одинаковых металлов для обоих электродов гальванический элемент рассматривается как концентрационный.
Не меняя стандартных условий возможно оценить механизм защиты, рассматривая сочетание металлов как гальванопару «подложка-покрытие».
Программа вычисляет значения равновесных потенциалов для каждого из электродов на основании введенных данных по металлам, концентрациям, температурам по уравнению Нернста E = E0 + [RT/(z*F)]*ln[C], определяет катодом тот электрод, потенциал которого - больше и анодом тот - потенциал которого меньше, после чего производит расчет ЭДС как разность потенциалов электродов ΔE = Eкатода - Eанода.
2. Cu/CuCl2//ZnCl2/Zn
CCu2+=2 M, CZn2+= 10-4 M
3. Дано: Ag/AgNO3||Ni(NO3)2/Ni- Схема гальванического элемента
CAg+=0,001M, CNi2+=0,5 M- Концентрация электронов.
Хлоридна кислота (HCl) реагує з алюмінієм (Al) за рівнянням:
2Al + 6HCl → 2AlCl₃ + 3H₂
З рівняння видно, що для повної реакції з 2 молекулами алюмінію (2Al), потрібно 6 молекул хлоридної кислоти (6HCl).
Тому, для реагування 54 г алюмінію, потрібно розрахувати кількість речовини (моли), використовуючи молярну масу алюмінію (молярна маса Al = 27 г/моль):
моль Al = маса Al / молярна маса Al = 54 г / 27 г/моль = 2 моля алюмінію
За рівнянням реакції, 2 моля алюмінію (2Al) реагують з 6 молями хлоридної кислоти (6HCl), що дає 3 моля водню (3H₂).
Отже, при повній реакції, утвориться 3 моля газу водню.
Нагадую, що умови "н.у." (нормальні умови) включають температуру 0 °C (273 K) і тиск 1 атмосфери (101.3 кПа).