№1:
а - 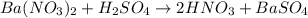
б - 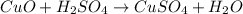
в - 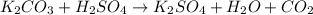
г - 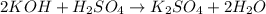
Про тесения реакций - извини, не очень понял, что требуется?
№3
Качественная реакция на сульфат - анион есть реакция с катионами бария: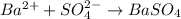 - выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
- выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
№4 В обе пробирки добавить несколько мл гидроксида бария. В пробирке с соляной кислотой пройдет обычная нейтрализация, видимых изменений не наблюдается, а в пробирке с серной кислотой выпадет белый осадок сульфата бария(ионные уравнения приведены выше)
Масова частка речовини в розчині визначається як співвідношення маси речовини до загальної маси розчину, виражене у відсотках.
Нехай потрібно добавити x грамів гідроксиду кальцію до 28 г оксиду кальцію, щоб одержати розчин Ca(OH)2 з масовою часткою 2%. Тоді маса розчину буде складати (x + 28) г.
Масова частка Ca(OH)2 у розчині складе 2%, тому маса Ca(OH)2 у розчині буде:
0.02(x + 28) г.
З іншого боку, масова частка Ca(OH)2 у розчині визначається масовою часткою гідроксиду кальцію, який міститься у розчині. Оскільки масова частка гідроксиду кальцію у розчині дорівнює 1%, маса гідроксиду кальцію у розчині буде:
0.01(x + 28) г.
Отже, звідси можна скласти рівняння реакції, яка відбувається між оксидом кальцію та гідроксидом кальцію у розчині:
CaO + H2O -> Ca(OH)2
З рівняння видно, що маса гідроксиду кальцію у розчині дорівнює масі оксиду кальцію, який віддає кисень та взаємодіє з водою. Тому маса гідроксиду кальцію у розчині дорівнює масі оксиду кальцію у реакції:
0.01(x + 28) г. = 28 г.
Розв'язуючи рівняння відносно x, отримуємо:
x = (0.02-0.01) * 28 / 0.01 = 28 г.
Тому, щоб одержати розчин Ca(OH)2 з масовою часткою 2%, потрібно додати 28 г гідроксиду кальцію до 28 г оксиду кальцію.