Электроотрицательность
Объяснение:
Это атома, связанного с другим атомом, притягивать к себе связующее электронное облако, вызывая тем самым поляризацию ковалентной связи.
Электроотрицаиельность—атома условная величина, характеризующая атома в молекуле приобретать отрицательный заряд (притягивать электроны). Зная электроотрицательность, можно определить полярность ковалентной связи, вычислить эффективные заряды атомов и др...
————
фундаментальное химическое свойство атома, количественная характеристика атома в молекуле притягивать к себе общие электронные пары.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов цезия до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
Дано: m(SO₃) = 20 грамм, η(NaOH) = 12 % – концентрация раствора.
Уравнение реакции: SO₃ + 2NaOH → Na₂SO₄ + H₂O
молярная масса SO₃: М(SO₃) = 32 + 3·16= 32 + 48 = 80 г/моль,
молярная масса NaOH: М(NaOH) = 23 + 16 + 1 = 40 г/моль,
количество вещества оксида серы VI:
ν(SO₃) = m(SO₃) : М(SO₃) = (20 г) : (80 г/моль) =  = 0,25 моль.
= 0,25 моль.
SO₃ + 2NaOH → Na₂SO₄ + H₂O. На один моль оксида серы VI приходится два моля гидроксида натрия ⇒ ν(NaOH) = 2ν(SO₃) = 2·0,25 = 0,5 моль;
масса NaOH равна: m(NaOH) = М(NaOH)·ν(NaOH) = 40·0,5 = 20 грамм,
η(NaOH) = [m(NaOH) · 100%] : m(раствора) ⇒ масса раствора равна:
m(раствора) = [m(NaOH) · 100%] : η(NaOH) = 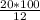 = 166,7 г
= 166,7 г
ответ: масса раствора равна 166,7 грамм
Увеличение давления смещает равновесие в сторону уменьшения объема, т.е. вправо (слева 3 моль газов, справа 2 моль газов). Соответственно, уменьшение давления смещает равновесие влево.
Увеличение концентраций реагентов (NO или Cl2) или уменьшение концентрации продукта (NOCl) смещает равновесие в сторону расходования реагентов, т.е. вправо. Соответственно, уменьшение концентраций реагентов или увеличение концентрации продукта смещает равновесие влево.
Про тепловой эффект ничего не сказано, потому сказать нельзя, как температура влияет на равновесие.