16.9%
Объяснение:
Пишем первую реакцию
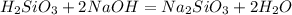
Считаем массу гидроксида натрия
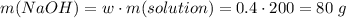
Считаем количество вещества кремниевой кислоты
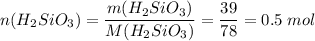
Для реакции нужно вдвое больше гидроксида натрия, т.е. 1 моль или 40 г, а есть 80 г, поэтому расчеты ведем по кремниевой кислоте
Силиката натрия образуется столько же, сколько и было кремниевой кислоты, т.е. 0.5 моль
Пишем вторую реакцию
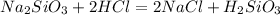
Для полного взаимодействия с 0.5 моль силиката натрия нужно 1 моль кислоты, т.е. 36.5 г. Считаем сколько есть
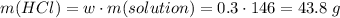
Видим, что соляной кислоты в избытке, поэтому расчеты ведем по силикату натрию
Во время реакции образуется 1 моль хлорида натрия, т.е. 58.5 г и 0.5 моль кремниевой кислоты, т.е. 39 г, которая выпадает в осадок и в массе раствора не считается
Считаем всю массу раствора
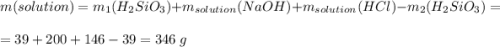
Считаем массовую долю хлорида натрия

Объяснение:
Многие химические реакции уравниваются подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
1)m(соды)=40*0.05=2(г)
2)50 - 100%
2 - х%
х=2*100/50=4(%)