
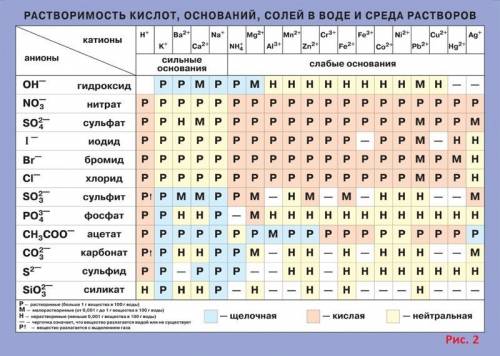
В результате взаимодействия гидроксида меди (II) с соляной кислотой (Cu(OH)2 + HCl = ?) образовалась средняя соль – хлорид меди (II) и вода. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода и гидроксид меди (II), представляющие собой малодиссоциирующие соединения, не распадаются на ионы.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (; ):
Это означает, что соляная кислота находится в избытке и дальнейшие расчеты производим по гидроксиду меди (II).
Согласно уравнению реакции
значит
Тогда масса хлорида меди (II) будет равна (молярная масса – 134,45 g/mole):
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4
Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV)
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3
К лабораторным получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(2) (при t = 100 °C)
На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком