Выберите один или два правильных ответа. 1. электронная оболочка атома самого активного неметалла 1)2е,8е,5е 2)2е, 4е 3)2е, 8е, бе 4) 2е, 8е, 4е 2. свойство, характерное для графита - 1) большая прочность 3) электропроводность 2) пластичность 4) высокая твердость 3. угарный газ поступает в атмосферу 1) в процессе фотосинтеза 2) во время грозы 3) при неполном сгорании топлива 4) при полном сгорании топлива 4. какие из газов можно собрать в пробирку, перевернутуювверх дном? 1) углекислый 2) водород 3) кислород 4) аммиак 5. содержание углекислого газа в воздухе уменьшается в результате 1) горения топлива 2) дыхания животных и растений 3) фотосинтеза 4) увеличения числа автомобилей 6 . при растворении углекислого газа в воде среда раствора — 1) нейтральная 3) соленая2) слабокислая 4) слабощелочная 7. кислотный характер оксида углерода (iv) реакций и 1)с02 + с = 2со 3) с02 + 2mg = 2mgo + с 2) с02 + сао = сасоз 4) с02 + 2naoh = na2c03 + h20 8. реакция распознавания углекислого 1) окислительно-восстановительная 3) замещения 2) разложения 4) обмена 9. угольная кислота и .. 1) сильная 2) слабая 3) неустойчивая 4) одноосновная 10. сумма всех коэффициентов в сокращенном ионном уравнении реакции карбоната натрия и хлорида кальция 1)6 2)4 3)3 4)5 11. качественной реакции на карбонаты соответствуют и 1) с032– + 2н+ - с02 + н20' 2) сасоз + 2н+ = са2+ + н20 + с02 3) с02 + 20н- - с032–+ н20 4) са2+ + соз2- = сасоз 12. укажите x в схеме превращения: сасоз + x → са(нс03)2: 1)са(он)2 2)н20 3)с02 4) с02 и н2013. 13.какие из газов собирают в пробирку, перевернутую вверх дном? 1)н2 2)с02 3)nh3 4)0214. 14.кремниевую кислоту можно получить из 1) si02 и н20 3) casi03 и с02 2) na2si03 и hc1 4) casi03 и н20 заранее .
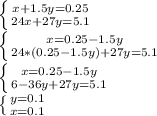 . Зная количество вещества каждого металла, можем найти массу этих металлов: m (Mg)=2.4 грамм, а m (Al)=2.7 грамм.
. Зная количество вещества каждого металла, можем найти массу этих металлов: m (Mg)=2.4 грамм, а m (Al)=2.7 грамм.