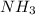 , сближающая его с щелочами, является хорошая "принимать" атомы водорода.
, сближающая его с щелочами, является хорошая "принимать" атомы водорода.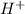 (а точнее
(а точнее 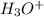 - катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь
- катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь 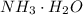 , которая в общем-то может образовать ионы
, которая в общем-то может образовать ионы 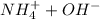 , хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).
, хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).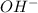 (к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
(к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
n(HCL)=30 моль
n(Fe2O3)/1=n(HCL)/6
n(Fe2O3)=30/6=5 моль
m(Fe2O3)=5*160=800 г