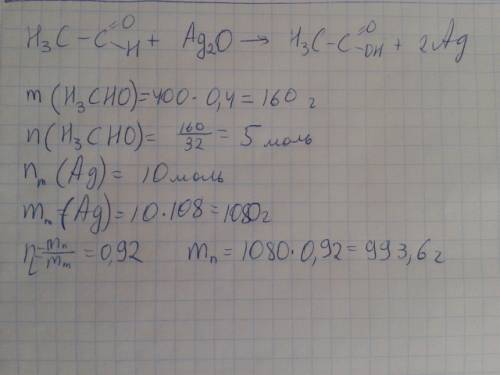
Объяснение:
1.Какой объем ацетилена (этина) потребуется для получения 2 кг. этаналя реакцией Кучерова? Определите классы указанных веществ. ацетилен - класс алкины; этаналь - класс карбонильные соединения.
Н+,Hg2+ 2кг
НС≡СН + НOH > CH3COH
Молярная масса этаналя - 44 г/моль и 2 кг этаналя соответствуют
45, 5 моль. Тогда и ацетилена потребуется 45,4 моль или 1019 л
при н.у.
2.Какое количество молекул пентанона-3 содержится в 20 моль данного вещества? Постройте структурную формулу данного вещества, определите его класс.
СН3-СН2 - С - СН2 - СН пентанон-3 класс кетоны
II
O
А в 20 моль любого вещества будет содержаться
6,02 ·10²³ моль⁻¹ х 20 моль = 1,2 · 10²⁵ молекул
3.Какая масса пропановой кислоты была использована для приготовления 100 мл 12 %-го раствора с плотностью 1,2 г/мл? Постройте структурную формулу данного вещества, определите его класс
СН3 -СН2-СООН класс карбоновые кислоты
Вычислим массу 12% раствора : 100мл × 1,2 г/мл =120 г . Найдем массу пропановой кислоты в растворе
120 г × 0,12 = 14,4 г
Электроотрицательность
Объяснение:
Это атома, связанного с другим атомом, притягивать к себе связующее электронное облако, вызывая тем самым поляризацию ковалентной связи.
Электроотрицаиельность—атома условная величина, характеризующая атома в молекуле приобретать отрицательный заряд (притягивать электроны). Зная электроотрицательность, можно определить полярность ковалентной связи, вычислить эффективные заряды атомов и др...
————
фундаментальное химическое свойство атома, количественная характеристика атома в молекуле притягивать к себе общие электронные пары.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов цезия до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.