№1
1) Находим массу раствора:
m(p-p) = m(FeCl₂) + m(H₂O) = 25 + 300 = 325 г
2) Массовую долю растворенного вещества находят по формуле:
ω = m(FeCl₂)/m(p-p) = 25/325 = 0,077
Это массовая доля выражена в долях единицы. Если нужно выразить в процентах, то это значение нужно умножить на 100%, то есть будет 7,7%
№2
1) Если концентрацию раствора выражена в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах, ω - массовая доля растворенного вещества, выраженная в долях единицы
2) При добавлении 20 г сахара масса растворенного вещества увеличивается на 20 г и на 20 г увеличивается масса раствора.
Так как плотность воды равна 1 г/мл, то 30 мл воды имеют массу 30 г и при добавлении 30 мл воды масса раствора увеличивается на 30 г.
Обозначим концентрацию полученного раствора через Х и на основании всего вышеизложенного составляем уравнение:
0,2*200 + 20 = Х*(200 + 20 + 30)
40 + 20 = 250Х
250Х = 60
Х = 0,24
ответ: 0,24 (или 24%)
1) Уравняем схему рекации:
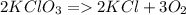
Из чего можно сделать вывод о том, что KCl образуется столько же, сколько KClO3 было. А O2 в 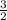 раза больше, поэтому.
раза больше, поэтому.
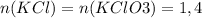 моль
моль
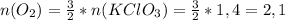 моль.
моль.
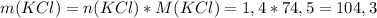 г
г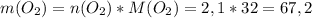 г
г
2) 3 Ba + 2 H3PO4 → 3 H2 + Ba3(PO4)2
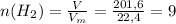 моль
моль
Бария столько же, сколько и водорода, следовательно 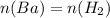
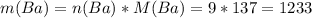 г
г
Фосфорной кислоты 3/4 от количества водорода
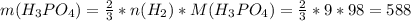 г
г
3) Поскольку 4,8% примесей, то
1000г*0,048=48 грамм примесей.
Тогда чистого железа
1000 - 48 = 952 г.
Fe+H2SO4 => FeSO4 + H2
n(Fe)=m/M=952/56=17 моль
Соли образуется столько же, сколько и железа было
n(Fe)=n(FeSO4)
m(FeSO4)=n*M = 17*152 = 2584 г
Водорода образуется столько же, поэтому
n(Fe)=n(H2)
V(H2)=n*Vm = 17* 22,4 = 380,8 л.
46 22,4
4,6 х
х = 2,24 л (теор. )
2,24 100%
х 90%
х = 2,016 л