дано:
m(р-ра CuCl2)=60г
w(CuCl2)=15%=0.15
найти:
остаток(Сu(OH)2)-?
РЕШЕНИЕ:
CuCl2+2KOH=Cu(OH)2стрелочка вниз+2KCl
подчеркиваешь одной чертой CuCl2,под этой чертой ставишь1 моль.Подчеркиваешь двумя чертами Cu(OH)2 стрелочка вниз,под этой чертой ставишь 1 моль,а над этой формулой х моль.
m(в-ва)=w*m(р-ра)=0,15*60г=9г
V(CuCl2)=m/M=9г/135г/моль=0,06мольэто пишешь над формулой CuCl2
состовляем пропорцию:0,06/1=х/1
х=0,06моль
m( Cu(OH)2стрелочка вниз)=M*V=0.06моль*98г/моль=6г
ответ: Cu(OH)2стрелочка вниз=6г
Оксид этого металла имеет формулу X2O3, где X это металл.
Нитрат этого оксида имеет формулу X(NO3)3.
30,6г * 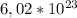 * 3 = 21,3г *
* 3 = 21,3г * 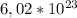 * 9
* 9
(2z+48)г/моль (z+186)г/моль
30,6 * 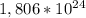 = 21,3 *
= 21,3 * 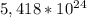
(2z+48) (z+186)
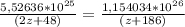
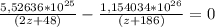 / (2z+48)(z+186)
/ (2z+48)(z+186)
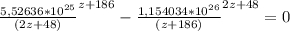
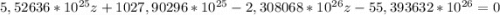
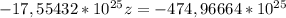
z ≈ 27
Такая атомная масса у алюминия. Проверим.
30,6г * 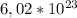 * 3 = 21,3г *
* 3 = 21,3г * 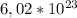 * 9
* 9
(54+48)г/моль (27+186)г/моль
0,3 * 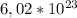 * 3 = 0,1 *
* 3 = 0,1 * 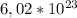 * 9
* 9
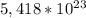 =
= 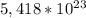
Идеально! Значит X = Al
Вам понадобится
- бумага;
- ручка;
- периодическая система Менделеева.
Инструкция
1
Чтобы определить количество электронов, воспользуйтесь периодической системой Д. И. Менделеева. В этой таблице элементы расположены в определенной последовательности, которая тесно связана с их атомным строением. Зная, что положительный заряд атома всегда равен порядковому номеру элемента, вы легко найдете количество отрицательных частиц. Ведь известно - атом в целом нейтрален, а значит, число электронов будет равно числу протонов и номеру элемента в таблице. Например, порядковый номер алюминия равен 13. Следовательно, количество электронов у него будет 13, у натрия – 11, у железа – 26 и т. д.
2
Если вам необходимо найти количество электронов на энергетических уровнях, сначала повторите принцип Пауля и правило Хунда. Потом распределите отрицательные частицы по уровням и подуровням с все той же периодической системы, а точнее ее периодов и групп. Так номер горизонтального ряда (периода) указывает на количество энергетических слоев, а вертикального (группы) – на число электронов на внешнем уровне.
3
Не забывайте о том, что количество внешних электронов равно номеру группы только у элементов, которые находятся в главных подгруппах. У элементов побочных подгрупп количество отрицательно заряженных частиц на последнем энергетическом уровне не может быть больше двух. Например, у скандия (Sc), находящегося в 4 периоде, в 3 группе, побочной подгруппе, их 2. В то время как у галия (Ga), который находится в том же периоде и той же группе, но в главной подгруппе, внешних электронов 3.
4
При подсчете электронов в атоме, учтите, что последние образуют молекулы. При этом атомы могут принимать, отдавать отрицательно заряженные частицы или образовывать общую пару. Например, в молекуле водорода (H2) общая пара электронов. Другой случай: в молекуле фторида натрия (NaF) общая сумма электронов будет равна 20. Но в ходе химической реакции атом натрия отдает свой электрон и у него остается 10, а фтор принимает - получается тоже
удачи
9 г
CuCl2 + KOH = Cu(OH)2 + 2KCl
135 г
т.к даны массы раствора хлорида меди, а в уравнении пишется только масса чистого вещества, то (15% /100) * 60 = 9 г - масса хлорида меди
рассчитываем молярную массу и пописываем под веществом