Объяснение:
На мой взгляд, фраза "окисляется даже кислородом воздуха" - несколько странновата для описания реакции с одним из сильнейших(!) (после фтора и, условно, озона) окислителей таблицы Менделеева.
Но тем не менее:
Гидроксид железа(II), как и в целом соединения железа(II) - содержат железо со степенью окисления(+2)
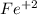
Данная степень окисления не является предельной для железа, коей выступает трехвалентное железо со ст. окисления(+3):
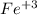
И дело в том, что железо(II) проявляет довольно выраженные свойства восстановителя.
Железо в соединениях со степ. окисления(+2) довольно легко отдает еще один электрон сильным окислителям, окисляясь при этом до (+3)
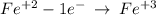
В том числе и гидроксид железа (II) окисляется кислородом воздуха (в присутствии воды!):
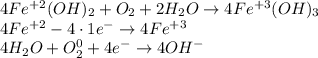
К слову, гидроксид железа(III) сам является окислителем, хоть и не очень сильным. И может восстанавливаться до соединений железа(II):
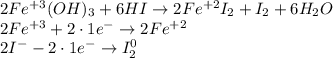
Однако, вследствие вышесказанного, гидроксид железа(II), как, в целом, и другие соединения железа(II) - является менее устойчивым, чем гидроксид (и др. соединения) железа(III), и окисляется до последнего, в т.ч. и кислородом воздуха (в присутствии воды).
C6H5-OH + 3HNO3 -> C6H2(NO2)3-OH + 3H2O