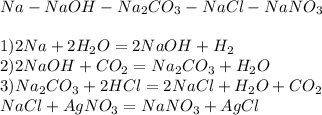
1) а) карбоновые кислоты формула ka
карбоновые кислоты всеми свойствами обычных кислот. они реагируют с активными металлами, основными , основаниями и солями слабых кислот:
2rcooh + мg → (rcoo)2mg + н2,
2rcooh + сао → (rcoo)2ca + н2о,
rcooh + naoh → rcoona + н2о,
rcooh + nahco3→ rcoona + н2о + со2↑.
карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
ch3coona + hcl → сн3соон + nacl.
соли карбоновых кислот в водных растворах гидролизованы:
сн3соок + н2о сн3соон + кон.
б) ch3-coohуксусная кислота
сн3 – сн2 – сн(с2н5) – сн(сн3) – сн2 – соон
2-метил-4-этилгексановая кислота
сн3соон +naoh = сн3сооna +н2о
Объяснение:
Решите две задачи.
а) Определите массу осадка, который образуется в результате реакции между 20 г гидроксида натрия и избытком раствора нитрата меди (II).
20 г х г
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
Масса гидроксида натрия 20 г. Это соответствует 0,5 моль NaOH. Таким образом, по уравнению реакции количество осадка составит 0,25 моль. Молярная масса гидроксида меди(II) равна 98 г/моль.
Вычислим массу осадка: 98 г/моль × 0,25 моль = 24,5 г.
б) Определите объём (н.у.) газа, образовавшегося в результате реакции между 19,6 г серной кислоты и избытком раствора карбоната калия
0,2 моль 0,2 моль
K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑
По уравнению реакции углекислого газа выделится такое же количество, сколько вступило в реакцию серной кислоты.
Вычислим количество серной кислоты: 19,6 г : 98 г/моль = 0,2 моль. Следовательно, объем газа: V(CO2) = 22 г/моль × 0,2 моль =
4,44 л.