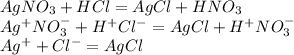
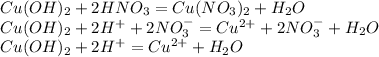
1 - Запишем уравнение реакции: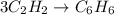
24 грамма бензола - есть масса теоретическая. Наша задача, рассчитать практическую массу. Как нам это сделать? Очень просто. Нам надо рассчитать количество вещества, бензола, которое образуется по уравнению реакции.
Первое что мы сделаем, это рассчитаем количество вещества ацетилена:
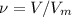 = 18,75л/22,4л/моль = 0,8 моль
= 18,75л/22,4л/моль = 0,8 моль
Теперь, смотрим на уравнение реакции, что мы видим:
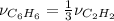 = 0,27 моль
= 0,27 моль
Рассчитываем массу:
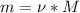 = 78г/моль*0,27моль = 21,06 грамм - это мы нашли массу практическую.
= 78г/моль*0,27моль = 21,06 грамм - это мы нашли массу практическую.
Теперь считаем выход:
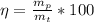 = 21,06г/24г*100 = 87,5%
= 21,06г/24г*100 = 87,5%
Ag+ NO3 - + H+ + Cl- =AgCl + H+ NO3 -
Cu(OH)2+2HNO3=Cu(NO3)2+H2O
Cu2+ + 2OH- + 2H+ 2 NO3- =Cu 2+ +2NO3- + H2O