Кто смыслит! 1) какие окислительно-восстановительные свойства может проявлять азот в азотной, азотистой кислотах и в аммиаке? подберите коэффициенты и укажите окислители и восстановители; определите принадлежность уравнения к одной из трех групп окислительно- восстановительных реакций: с+н2sо4→с02+н20+s02. 2) в состоянии равновесия в системе n2+зн2=2nнз, ∆h=-92,4 кдж, равновесные концентрации участвующих веществ составили: азота - 3 моль/л, водорода - 9 моль/л, аммиака - 4 моль/л. определите: исходные концентрации азота и водорода, как сместится равновесие в системе при повышении температуры, при увеличении давления. 3) в какую сторону сместится равновесие реакции и почему? 2n2+02 →2n20- 160,36 дж а) при повышении давления; б) при понижении температуры?
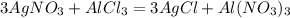
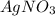 ) = 170 г/моль
) = 170 г/моль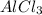 ) = 132 г/моль
) = 132 г/моль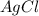 ) = 143 г/моль
) = 143 г/моль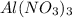 ) = 213 г/моль
) = 213 г/моль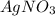 ) = 23,8/(170 * 3) = 0,047 моль
) = 23,8/(170 * 3) = 0,047 моль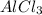 ) = 5,34/132 = 0,040 моль
) = 5,34/132 = 0,040 моль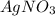 - избытке, значит расчет ведем по
- избытке, значит расчет ведем по 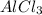
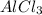
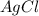 ) = (5,34 * 143 * 3)/132 = 17,35 г
) = (5,34 * 143 * 3)/132 = 17,35 г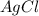 и
и 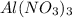 - продукты реакции и не прореагировавший
- продукты реакции и не прореагировавший 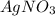
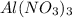 ) = 5,34 * 213 / 132 = 8,62 г
) = 5,34 * 213 / 132 = 8,62 г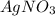 ) = 170 * 3 * 5,34 / 132 = 20,63 г - израсходовалось в ходе реакции
) = 170 * 3 * 5,34 / 132 = 20,63 г - израсходовалось в ходе реакции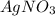 ) = 23,8 - 20,63 = 3,17 г - не прореагировало
) = 23,8 - 20,63 = 3,17 г - не прореагировало
C⁰ + 2H⁺¹₂S⁺⁶O⁻²₄= C⁺⁴O⁻²₂ + 2S⁺⁴O⁻²₂ +2H⁺₂O⁻²
восс-ль C⁰-4e⁻=C⁺⁴ |1| окисление
окис-ль S⁺⁶+2e⁻=S⁺⁴|2| восстановление
Межмолекулярное окисление и восстановление
2. N₂+3H₂=2NH₃ + 92 кДж
Исходная концентрация аммиака равна 0. Тогда при образовании 4моль/л NH₃, было использовано ( по уравнению): х у 4
N₂ + 3H₂= 2NH₃
1 3 2
y=6 моль/л (H₂), x=2 моль/л ( N₂)
Исходная концентрация (H₂) 9+6=15 моль/л
Исходная концентрация (N₂) 3+2 =5моль/л
По принципу Ле Шателье, при повышении температуры увеличивается скорость эндотермической реакции, следовательно увеличится скорость обратной реакции(идет в сторону образования исходных вещества)
При увеличении давления увеличивается скорость той реакции, в ходе которой образуется меньшее число молекул, следовательно, увеличится скорость прямой реакции (идущей в сторону образования продукта реакции)
3. 2N₂ +O₂=2NO -160,36 кДж
По принципу Ле Шателье, при
повышении давления увеличивается скорость той реакции, в ходе которой образуется меньшее число молекул, следовательно, в данном случае, изменение давления не разрушит равновесие.
При понижении температуры увеличивается скорость реакции, в ходе которой тепло выделяется (экзотермический процесс). В данном случае увеличится скорость обратной реакции.