6,96 г х г
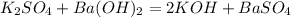
174 г 233 г
1. Определим массу сульфата калия в растворе:
m(K2SO4)=m(раствора)*w(K2SO4)=87*0,08=6,96 г
2. Подставив эту массу в уравнение реакции,определим массу выпавшего сульфата бария:
при взаимодействии 174 г сульфата калия выпадает 233 г осадка, а
при --//--//--//-- 6,96 г__________________________х г, откуда
х=233*6,96/174=9,32 г
3,9 г 16 г, х г у л
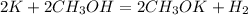
78 г 64 г 22,4 л
1. Определяем,какое из исходных веществ прореагирует полностью без остатка,приняв массу одного,например спирта,за Х:
при взаимодействии 78 г калия необходимо 64 г спирта, а
при --//--//--//-- 3,9 г____________________х г, откуда х=3,9*64/78=3,2 г
2.Как видим,спирт дан в излишке,значит расчет объема водорода ведем по массе калия:
при взаимодействии 78 г калия выделяется 22,4 л водорода, а
при --//--//--//-- 3,9 г__________________у л, откуда у=3,9*22,4/78=1,12 л
p- элемент
1 валентный электрон