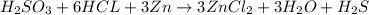

Число протонов и электронов не меняется, если это не ядерная реакция, а вот число электронов вполне.
Атом Ni отдал 3 электрона, а значит стоит вычесть из его порядкового номера цифру 3 и получить: 28-3 = 25е¯. Найдем количество нейтронов: 59-28 = 31(n)
Атом P наоборот принял три электрона, значит всего электронов он имеет: 15+3 = 18е¯. Найдем количество нейтронов: 31-15 = 16(n)
ВАЖНО! Количество протонов в атоме равно порядковому номеру элемента, а количество нейтронов равняется Ar(атомная масса элемента) - порядковый номер элемента.
Изменение свободной энергии Гиббса ΔG⁰ для данной реакции рассчитывается по формуле:
∆G (реакции) = ∆H(реакции) – T∆S (реакции)
1) Изменение энтальпии реакции равно разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов в уравнении реакции). Используя справочник физико-химических величин определяем ∆H:
∆H⁰ (реакции) = Σ ni ∆H(прод) - Σ ni ∆H(исх.)
∆H⁰ (реакции) = 3*∆H⁰ (Н2О)(ж) – ∆H⁰ (Fe2O3) (к) = 3 ⋅ ( - 285,8) - ( - 822,0) = - 35,4 кДж
2) Находим ∆S⁰(реакции:
∆S⁰(реакции) = [2*∆S⁰ (Fe) + 3*∆S⁰(Н2О)(ж)] – [∆S⁰(Fe2O3) (к) +3*∆S⁰(Н2)(г)] = (3 ⋅ 70,1 + 2 ⋅ 2,27) - (87,0 + 3 ⋅ 130,5) = = – 213,8 Дж/К = – 0,2138 кДж/К
3) Находим ∆G:
∆G = ∆H – T*∆S = –35,4 – 298*(– 0,2138) = -35,4 + 63,7 = 28,34 кДж
Положительное значение ΔG указывает на невозможность самопроизвольного протекания данной реакции при стандартных условиях.