Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Объяснение:
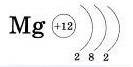
.а) Магний расположен в третьем периоде (если полностью: в третьем периоде, 2 группы, главной подгруппы) значит, он имеет три оболочки, одна из которых внешняя, содержащая валентные электроны. Атом магния имеет положительно заряженное ядро (+12), в котором имеется 12 протонов и 12 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 12 электронов.
Электронную конфигурацию атома магния можно записать двояко:
+12Mg)2)8)2; (на картинке понятнее)
1s22s22p63s22Mg + H2 = 2MgH
На воздухе в компактном состоянии он устойчив, но мелко раздробленный самовозгораться. С холодной водой вследствие низкой растворимости Mg (OH) магний реагирует медленно, но нагревание заметно ускоряет реакцию:
Mg + 2НO = Mg (OH)
Магний легко растворяется в кислотах с выделением водорода:
Mg + 2HCl = MgCl2 + H2
Щелочи на него не действуют. Следовательно, амфотерность у соединений магния отсутствует.
При нагревании диоксида кремния с избытком металлического магния восстанавливающийся кремний соединяется с магнием, образуя силицид магния MgSi:
4Mg + SiO = MgSi + 2MgO
При нагревании на воздухе магний сгорает, образуя оксид магния MgO:
2Mg + O = 2 MgO
Cu(2+) + SO4(2-) + 2Na(+) + 2OH(-) = Cu(OH)2 + 2Na(+) + SO4(2-) (полное ионное)
Cu(2+) + 2OH(-) = Cu(OH)2 (сокращенное ионное)