1. s+o2=so2
2. so2+o3=so3+o2
3. so3+h2o=h2so4
4. h2so4+ca(oh)2=caso4+2h2o
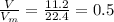 моль
моль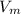 =0.25*22.4=5.6 л
=0.25*22.4=5.6 л1) Молярная концентрация раствора показывает сколько молей данного вещества содержится в 1 л раствора. А нормальная концентрация показывает, сколько моль-эквивалентов данного вещества находится в 1 л раствора.
2) Na₂CO₃ молярная масса вдвое больше молярной массы эквивалента. Значит 0,25Н раствор, это 0,125М раствор.
3) Чтобы узнать количество молей растворенного вещества в растворе, нужно молярность умножить на количество литров раствора.
2) Обозначим объём 1,5М раствора через Х литров.
При разбавлении раствора количество молей растворенного вещества не изменяется, на основании этого можем написать уравнение:
1,5 * Х = 0,125 * 2
1,5Х = 0,25
Х = 0,167 л = 167 мл
2SO₂ + O₂ ⇒ 2SO₃ (при 450°С , кат. V₂O₅)
SO₃ + H₂O ⇒ H₂SO₄
H₂SO₄ + CaO ⇒ CaSO₄ + H₂O