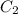 : m(примесей)= 128г*0.05 =6.4г , а значит m(Са
: m(примесей)= 128г*0.05 =6.4г , а значит m(Са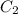 ) = 128г-6.4г = 121.6г.
) = 128г-6.4г = 121.6г. )= 121.6г / 64г/моль = 1.9 моль
)= 121.6г / 64г/моль = 1.9 моль  ) = 1.9 моль * 26 г/моль = 49.4 г
) = 1.9 моль * 26 г/моль = 49.4 г = 49.4 г * 0.8 = 39.52 г
= 49.4 г * 0.8 = 39.52 г г
г
Из условия задачи следует, что на платиновом катоде происходит восстановление катионов никеля до металла:
Ni 2+ + 2e- = Ni
На платиновом аноде будет происходить окисление воды до свободного кислорода:
H2O – 2e- = 2 H+ + ½ O2
Суммарное уравнение:
NiSO 4 + H2O = Ni + H2SO4 + 1/2 O2
A(Ni) = 58.693 г/моль
По закону электролиза Фарадея масса выделившегося металла m равна:
m = ItM/(Fz),
где I-сила тока (А или Кл/с), t – время (с), M – молярная масса металла (г/моль), F – постоянная Фарадея (96485 Кл/моль), z – число электронов, участвующих в реакции восстановления металла.
t = Fmz/(MI) = 96485 Кл/моль * 5,9 г * 2 / (58,693 г/моль * 1,5 Кл/с) = 12932 с = 3 ч 35 м 32 с
m(CaC2)=128г
w(примеси)=5%=0.05
d(C2H2)=80%=0.8
(d-выход от теоретической возможности ,только в данном случае обозначил буквой d,она обозначается по-другому)
Hайти:
V(C2H2)-?
Решение:
CaC2+2H2O=C2H2+Ca(OH)2
Найдем массу чистого CaC2 (100%-5%=95%=0.95)
m(CaC2)=128*0.95=121.6г
M (CaC2)=64г/моль
n(CaC2)=m/M=121.6/64=1.9моль
По реакции видим, что :
n(CaC2)=n(C2H2)=1.9моль
V=n*Vm*d
V(C2H2)=1.9*22.4*0.8=34.048л
ответ:34.048л