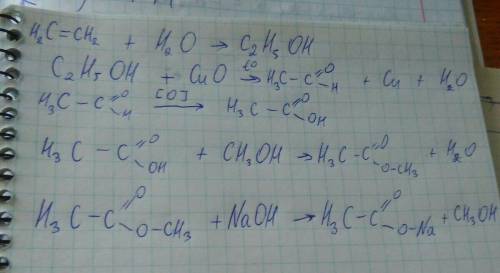
Объяснение:
Характеристика магния:
1) Название элемента -магний,
химический символ - Mg, порядковый номер - № 12 ,
атомная масса Ar=24 Группа - 2, подгруппа- главная , 3-й период
Заряд ядра атома магния Z=+12 (в ядре 12 протона-p⁺ и 12 нейтрона - n⁰)
Вокруг ядра атома 3 энергетических уровня, на которых располагаются 12 электрона.
3) Исходя из вышеизложенного напишем модели строение атома магния:
а). Модель атома магния при дуг:
₊₁₂Mg)₂)₈)₂
б). Модель атома -электронная формула алюминия
₊₁₂Mg1s²2s²2p⁶3s²
в).Электронно-графическая модель атома:
3уровень ⇵
⇅ ⇅ ⇅
2уровень ⇅
1уровень ⇅
₊₁₂Mg
4. Простое вещество магний металл, состоит из одного атома.
Как простое вещество магний взаимодействует:
с кислородом, образуя оксид магния;
с водородом, образуя гидрид магния;
с кислотами, образуя соли магния, с солями, образованными металлами, стоящими в ряду активности после него (он вытесняет ионы металла из соли).
Его сложные вещества: оксид магния основной оксид, гидроксид магния-основание, нерастворимое в воде, соли магния растворимы в воде, за исключением фторида магния, фосфата магния, карбоната магния и силиката магния.
5. Молекулы атомов в 2 группе, главной подгруппе одноатомные. С увеличением заряда ядра от бериллия до радия неметаллические свойства уменьшаются, а металлические усиливаются.
6. Молекулы атомов простых веществ в периоде: натрий, магний, алюминий, кремний - одноатомные; фосфора четырехтомные P₄, серы многоатомные (S)n,хлора двухатомные CI₂. От натрия к хлору меняются свойства веществ: натрий, магний - металлы, алюминий -амфотерный металл, кремний полуметалл, фосфор, сера, хлор - неметаллы. Также слева направо в периоде меняются окислительно-восстановительные свойства. Натрий, магний, алюминий - восстановители. Кремний, фосфор, сера, хлор - могут быть как восстановителями, так окислителями.
7. Формула высшего оксида: MgO – основной оксид
8. Формула гидроксида: Mg(OH)₂- основание нерастворимое в воде.
9. Летучего соединения с водородом не образует, а соединение магния с водородом - это гидрид алюминия MgH₂ -Представляет собой твёрдое белое нелетучее
10. Валентность магния в соединениях равна 2, степень
окисления+2 . Магний –восстановитель.
Характеристика углерода:
1) Название элемента -углерода,
химический символ -C , порядковый номер - № 6 ,
атомная масса Ar=12 Группа - 4, подгруппа- главная , 2-й период
Заряд ядра атома углерода Z=+6 (в ядре 6 протонов-
p⁺ и 6 нейтронов - n⁰)
Вокруг ядра атома 2 энергетических уровня, на которых располагаются 6 электронов.
3) Исходя из вышеизложенного напишем строение атома магния и его электронную формулу:
а). Модель атома углерода при
дуг: ₊₆C)₂)₄
б). Модель атома, через электронную формулу (электронная конфигурация):
электронная формула углерода ₊₆C 1s²2s²2p²
в).Электронно-графическая модель атома углерода:
↑ ↑
2уровень ⇅
1уровень ⇅
₊₆C
4. Простое вещество углерод неметалл, состоит из
одного атома. Углерод имеет три аллотропные видоизменения: углерод, алмаз, гафит. Сложные соединения углерода: с кислородом образует два оксида CO-несолеобразующий оксид и CO₂ солеобразующий оксид и кислоту. С металлами образует соединения карбиды. H₂CO₃ -угольная кислота летучая кислота ее соли лития, калия, натрия, аммония -растворимы в воде, соли образованные с другими металлами нерастворимы, легко разлагаются при нагревании.
5. Молекулы атомов в 4 группе, главной подгруппе
одноатомные. С увеличением заряда ядра от углерода до свинца неметаллические свойства уменьшаются, а металлические усиливаются. Свинец типичный металл.
6. Молекулы атомов простых веществ в периоде: литий, бериллий, бор, углерод - одноатомные; азот, кислород, фтор двухатомные CI₂, неон одноатомный От лития к фтору меняются свойства веществ: литий- металл, бериллий- металл с амфотерными свойствами, углерод, азот, кислород, фтор- неметаллы. Также слева направо в периоде меняются окислительно-восстановительные свойства..
7. Формула высшего оксида:CO₂ – основной оксид
8. Формула гидроксида H₂CO₃: летучая угольная кислота .
9.Летучего соединения с водородом образует, Моносилан — бинарное неорганическое соединение кремния и водорода с формулой SiH₄, бесцветный газ с неприятным запахом, самовоспламеняется на воздухе, реагирует с водой, ядовит.
10. Валентность углерода в соединениях равна 4, степень окисления+4, -4 . Углерод–может быть, как восстановителем, так и окислителем