Среда раствора - есть те ионы, которые образовались при гидролизе. Т.е. если при гидролизе у нас образовались катионы водорода 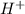 - то среда кислая, если образовались гидроксид - анионы
- то среда кислая, если образовались гидроксид - анионы 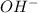 - то среда щелочная.
- то среда щелочная.
Теперь определимся, когда у нас образуются катионы водорода, т.е. кислая среда, а когда гидроксид - анионы, т.е. щелочная среда.
Когда речь идет о гидролизе соли слабого основания и сильной кислоты, то среда будет кислой. Что значит соль сильной кислоты и слабого основания? И так непонятно, так еще и слабые с сильными нарисовались?) Объясняю:
Соль слабого основания - т.е. соль в которой металл взят от нерастворимого основания, например - 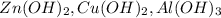 , а сильной кислоты - значит кислотный остаток соли мы украли у сильной кислоты например -
, а сильной кислоты - значит кислотный остаток соли мы украли у сильной кислоты например - 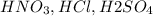 .
.
Пример гидролиза такой соли. Возьмем хлорид меди (II) - который есть в задании: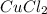 - медь, ее гидроксид в воде нерастворим, значит соль слабого основания, хлор - хлороводородная кислота - сильная, значит соль сильной кислоты и слабого основания, гидролиз идет по слабому - т.е. по катиону меди.
- медь, ее гидроксид в воде нерастворим, значит соль слабого основания, хлор - хлороводородная кислота - сильная, значит соль сильной кислоты и слабого основания, гидролиз идет по слабому - т.е. по катиону меди.
1ст.
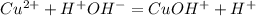 <- сразу - катионы водорода - кислая среда, значит как вариант ответа - не рассматриваем, нам нужна щелочная среда.
<- сразу - катионы водорода - кислая среда, значит как вариант ответа - не рассматриваем, нам нужна щелочная среда.
Я далее писать уравнение гидролиза не буду, если возникнет желание разобраться, пишите в ЛС
Вернемся к заданию - такую же реакцию среды - кислую имеет хлорид аммония - слабое основание и сильная кислота.
Нитрат калия - это экзотика - среда нейтральная.
Остается один вариант - 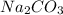 - это как раз то, что мы ищем.
- это как раз то, что мы ищем.
Катион натрия - взят от гидроксида натрия - сильного основания - знаяит соль сильного основания, карбонат - анион - всзят от слабой угольной кислоты, значит среда раствора - щелочная, так как соль сильного основания и слабой кислоты
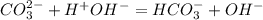 видим гидроксид анионы - среда щелочная.
видим гидроксид анионы - среда щелочная.
P.S. Если возникнет желание продолить уравнение гидрорлиза, но не получается, пиши в ЛС
Задачка №1
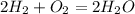
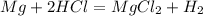
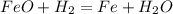

Думаю, что в этом задании трудностей не должно возникнуть
Задачка №2
Такие задачки решают через уравнени реакции:
Вот собственно и оно: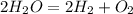
Теперь вычислим количество вещества воды:
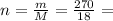 15 моль
15 моль
Теперьт анализируем уравнение реакции и в результате анализа узавнем, что количество вещества воды равно количеству вещества водорода: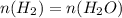 = 15 моль
= 15 моль
По тому же анализу выводим, что количество вещества кислорода в два раза меньше, т.е. 15/5 = 7,5моль
И считаем массу:
m(водорода) = n*M = 15моль*2г/моль = 30 грамм
m(кислорода) = M*n = 7,5моль*32г/моль = 240 грамм
Задачка №3
На массовые доли еще проще.
Сначала вычислим молекулярную массу вещества:
Mr(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1 + 14 + 48 = 63
Теперь, чтобы узначть массовую долю каждого элемента, надо Ar каждого из них, и водорода, и кислорода, и азота, поделить на молекулярную массу, на 63, в общем виде: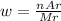 - n показывает сколько элемента в молекуле, водорода с азото по одному, поэтому n = 1, кислорода три, значит n = 3
- n показывает сколько элемента в молекуле, водорода с азото по одному, поэтому n = 1, кислорода три, значит n = 3
Считаем массовые доли:
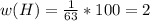
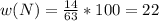
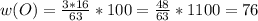
Задача №4
Это аммиак NH3
Пусть n - число атомов водорода, а - m - число атомов азота, молярные массы водорода и азота равны 1 и 14 сответственнно.
Тогда
n/(n*1 + m*14) = 0.17
n = 0.17n + 2.38m
0.83n = 2.38m
n/m = 2.38/0.83 ~ 3
Значит отношение атомов водорода и азота равно 3
NH3
1)Zn+H2So4=ZnSo4+H2
2)ZnSo4+2H2O=Zn(OH)2+H2SO4
3)Zn(OH)2+CO2=ZnCo4+H2