№1:
а - 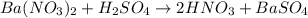
б - 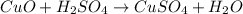
в - 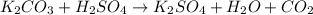
г - 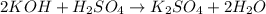
Про тесения реакций - извини, не очень понял, что требуется?
№3
Качественная реакция на сульфат - анион есть реакция с катионами бария: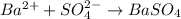 - выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
- выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
№4 В обе пробирки добавить несколько мл гидроксида бария. В пробирке с соляной кислотой пройдет обычная нейтрализация, видимых изменений не наблюдается, а в пробирке с серной кислотой выпадет белый осадок сульфата бария(ионные уравнения приведены выше)
Припускаємо що в нас є 100 см^3 розчину HCl з масовою часткою HCl 2%. Густина такого розчину приблизно рівна 1.
Тоді : m (p HCl) = 100 x 1 = 100г.
m(HCl) = 0.02 x 100 = 2г.
Знайдемо скільки молів HCl у нас присутньо : для цього скористаємось формулою n(речовини)=m(речовини)/M(речовини)
n(HCl) = 2/36.5 = 0.0548 моль.
Знайдемо концентрацію HCl в цьому розчині з формули : C = n/V.
V (pHCl) = 100 см^3
C(HCl) = 0.0548/100 = 0.000548 моль/cм^3.
Концетрація йонів H(+) буде такою самою як і концетрація HCl.
Величину pH знайдемо з формули pH = -lgC(H+).
Тоді pH(2% р-ну HCl) = -lg(0.000548) = 3.26
1)Образовался нитрат магния- MgNO3
2)2ZnO+2HNO3=2ZnNO3+H2O
n(ZnO)=m/M=16.2 г/65 г/моль=0,2
n(HNO3)=30 г\63г\моль=0,5
ZnO полностью вступает в реакцию, HNO3- с избытком.Проводим расчеты с веществом полностью вступающим в реакцию.
n(ZnO)=n(HNO3)=0,2-по уравнению
m(ZnNO3)=nM=0.2 моль*189г\моль=37,8г