287 мл
Объяснение:
Магниевые опилки массой 12г погрузили в раствор сульфата меди 2. После завершения реакции металлический осадок отделили , его масса составила 20г . Рассчитайте минимальный объем раствора азотной кислоты ( массовая доля 36% , плотность 1,22 г/мл), который потребуется для растворения полученного металлического осадка. Считать , что продукт восстановления кислоты металлом является оксид азота 2. ответ:287мл.
запишем уравнение реакции:
Mg + CuSO4 = MgSO4 + Cu↓
Масса магния 12 г, что соответствует 0,5 моль. Если магний прореагировал полностью, то масса меди в осадке тоже составляет 0,5 моль или 32 г.
Эту массу меди растворили в азотной кислоте.
0,5 моль
Сu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
По уравнению реакции, если количество меди 0,5 моль, то азотной кислоты по уравнению реакции потребуется в 4 раза больше или 2 моль.
Молярная масса азотной кислоты 63 г/моль. Масса азотной кислоты: 63 г/моль × 2 моль = 126 г.
Вычислим массу 36% раствора азотной кислоты
126 г : 0,36 = 350 г.
Зная плотность раствора 1,22 г/мл найдем объем раствора азотной кислоты: 350 г : 1,22 г/мл = 287 мл
Объяснение:
7.32% HCl; 143 г Воды; 5% KCl
Объяснение:
1) 2K + 2H2O = 2KOH + H2
m(K)= 5.85г
n(K) = 5.85÷39 = 0.15 моль
m(KOH) = 0.15 × 56 = 8.4г
m(H2O) = 18×0.15= 2.7 г
Калий и гидроксид калия относятся друг к другу 1 к 1. Значит гидроксида калия образовалось тоже 0.15 моль
2)KOH + HCl = KCl + H2O
n(KOH) = 0.15
Гидроксид калия и соляная кислота относятся друг к другу как 1 к 1, значит соляная кислота была использована кол-вом 0.15 моль
n(HCl) = 0.15 моль
m(HCl) = 0.15 × 36.5 = 5.475 грамм
w%(р-ра) =
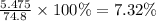
Массовая доля HCl в растворе была 7.32% (ответ 2)
3) Масса раствора после нейтрализации 223.5 г
Если мы отнимем массу раствора соляной кислоты от итоговой массы раствора: 223.5 - 74.8 = 148.7 это масса первого раствора KOH и вода, так как она была в избытке.
148.7 - 8.4 + 2.7 = 143 г Воды (ответ 3)
148.7 - масса первого раствора
8.4 масса KOH
2.7 масса воды, которая вступила в реакцию
4) n(KCl) = 0.15
m(KCl) = 11.175
m(р-ра) = 223.5
w%(р-ра)=
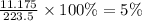
ответ: 5%
Если будут вопросы , отвечу с удовольствием в комментариях.
120 т воды-это 120 000 кг или 120 000 л,т.е.120 000*0,002=240 мг или 0,24 г
Если 71 г хлора занимает объем 22,4 л, то
0,24 гх л, откуда х=22,4*0,24/71=0,08 л