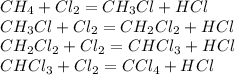
Реакция электролиза:
NiCl2 --> Ni + Cl2
n(пpCl2) = V(Cl2)/Vm ( Vm - молярный объем, равен 22,4л/моль при н.у., буквы "пр" обозначают что это практическая величина, то, что получили реально).
n(пpCl)2 = 16/22,4 = 0,71моль.
m(пpCl2) = M(Cl2)*n(прCl2) = 0,71*71 = 50,41г.
Находим массу хлора которая должна была выделится - теоретическую:
m(тCl2) = m(прCl2)/выход = 50,41/0,893 = 56,45 г.
n(тCl2) = m(тCl2)/M(Cl2) = 56,45/71 = 0,795 моль.
По уравнению реакции видно, что количество хлора равно количеству никеля: n(тCl2) = n(тNi) = 0,795моль.
m(тNi) = M(Ni)*n(тNi) = 59*0,795 = 46,9г - столько никеля должны были получить по рассчетам.
Находим выход: выход = m(прNi)/m(тNi) = 33,04/46,9 = 0,704 или 70,4%.
n(CO2) = m(CO2)/M(CO2) = 0,88/44 = 0,02моль.
n(H2O) = m(H2O)/M(H2O) = 0,36/18 = 0,02моль.
При полном сгорании весь углерод из углеводорода перехрдит в СО2, а вест водород в Н2О. Значит n(C) = n(CO2) = 0,02моль,
n(H) = 2*n(H2O) = 2*0,02 - 0,04моль.
Мольное соотношение углерода к водороду n(C):n(H) = 0,02:0,04 = 1:2. Простейшая формула углеводорода СН2.
M(УВ) = D*M(H2) = 21*2 = 42г/моль.
В 42г/моль молекулярная масса СН2 "умещается" 42/14 = 3 раза. Значит истинная формула углеводорода С3Н6. Это может быть непредельный углеводород пропен, или циклический циклопропан.