1) 2Al + Fe2O3 → Fe↓ + Al2O3 + Q
тв. тв. тв. тв.
Реакция замещения, экзотермическая, окислительно-восстановительная, гомогенная, некаталитическая, необратимая.
2) Pb(NO3)2 → PbO + NO2↑ + O2↑ - Q
тв. тв. газ газ
Реакция разложения, эндотермическая, окислительно-восстановительная, гетерогенная, некаталитическая, необратимая.
Объяснение:
Обмен - AB + CD = CB + AD
Замещение - A + BC = AC + B
Соединение - A + B = AB
Разложение - AB = A + B
Экзотермическая - с выделением тепла (+Q)
Эндотермическая - с поглощением тепла (-Q)
Окислительно-восстановительная - с изменением степеней окисления
Гомогенная - реакция, протекающая в одной фазе,
Гетерогенная - реакции, протекающая на границе раздела фаз (агрегатных состояний)
Некаталитическая - без участия катализатора
Каталитическая - с участием катализатора
Необратимая - реакция, идущая в одном направлении
Обратимая - реакция, идущая одновременно в двух противоположных направлениях
1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
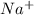

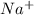
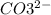

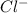
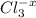


6Na(+) + 2PO4(3-) + 3Ca(2+) + 6NO3(-) → Ca3(PO4)2 + 6Na(+) + 6NO3(-)
2PO4(3-) + 3Ca(2+) → Ca3(PO4)2
2) Na2S + CuSO4 → CuS↓ + Na2SO4
2Na(+) + S(2-) + Cu(2+) + SO4(2-) → CuS + 2Na(+) + SO4(2-)
S(2-) + Cu(2+) → CuS
3) MgCl2 + HNO3 → реакция не идет, так как все растворимо
SnCl4 — степень окисления Sn +4.
H2CO3 — степень окисления С +4.