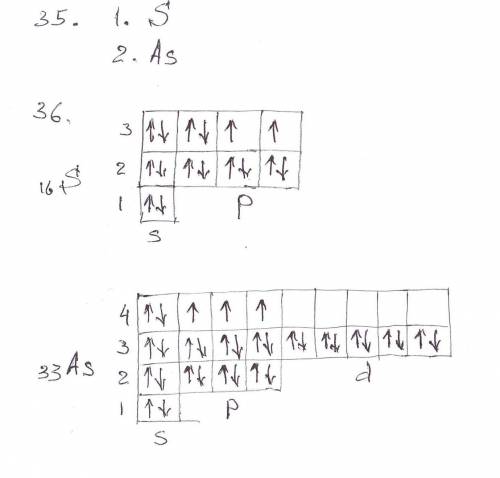
36. Дописать название подуровня и его номер. Записать химический знак элемента и перед ним поставить его порядковый номер. (См. в файл)
37. Номеру данного периода.
38. Номеру группы.
39. Количеством валентных электронов, т.е. электронов на внешнем слое.
40. Изменением строения их электронных оболочек. В каждом периоде происходит заполнение электронами внешнего энергетического уровня до восьми. Следовательно, электронные конфигурации наружных энергетических уровней периодически повторяются.
41. s-элементы - это элементы главной подгруппы I и II групп. По факту это элементы у которых заполняется s-уровень. В каждом периоде по 2 s-элемента.
42. р-элементы - это элементы III-VIII групп, главных подгрупп. Это элементы у которых заполняется р-уровень. Всего 6 р-элементов в каждом периоде (кроме первого, их там нет; и седьмого - хотя там тоже их 6 штук).
43. d-элементы - это элементы I-VIII групп, побочных подгрупп. Это элементы у которых заполняется d-уровень. В каждом большом периоде по 10 d-элементов.
Объяснение:
H₂+Cl₂--->2HCl
n(H₂)=V/Vm=22.4/22.4=1моль
n(Cl₂)=V/Vm=11.2/22.4=0.5моль
Т.к. хлора недостаток,то он провзаимодействует полностью, и расчеты ведем по нему.
n(HCl)=n(Cl₂)*2=0.5*2=1моль
В сосуде после реакции останется водород и хлороводородная кислота.
n(H₂остаток)=1-0.5=0.5моль => V(H₂)=n*Vm=0.5*22.4=11.2л
М(HCl)=n*Vm=1*22.4=22.4л
ответ: V(H₂)=11.2л ; V(HCl)=22.4л