Дано: m (FeCl3) = 4.3 кг = 0,0043 г
Найти: V (Cl)
Решение: составим уравнение реакции: 2Fe + 3Cl2 = 2FeCl3
V = n * V m ( Vm - это молярный объем )
M ( Cl2) = 35.5 * 2 = 71 ( но т.к в уравнении реакции 3Cl2, то)
M (3Cl2) = 71 * 3 = 213
M (FeCl3) = 56* 35,5 * 3 = 162,5 ( но т.к в уравнении реакции 2FeCl3, то)
M (2FeCl3) = 162,5 * 2 = 325
составим пропорцию: х = 0,0043 г
213 = 325
следовательно, m ( Cl 2) = 0,0043 г * 213 : 325 = 0,00282 г ( 2,82 кг)
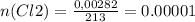
Итак, теперь V ( Cl2 ) = 0.00001 * 22.4 = 0.00022 л.
ответ: V ( Cl2 ) = 0.00022л.
1)
а)Напишем уравнение реакции:
2Al(OH)3+3H2SO4===>Al2(SO4)3+6H2O
Из уравнения реакции можно сделать вывод: v(Al2(SO4)3)=2v(Al(OH)3)
v(Al(OH)3)=m/M=7300г/78г/моль=93,6 моль
Значит v(Al2(SO4)3)=1/2*93,6 моль=46,8 моль
m(Al2(SO4)3)=v*M=46,8моль*342г/моль=16005,6 г
б)Мы узнали сколько всего было вещества вместе с примесями,теперь нужно узнать сколько чистого вещества(без примесей) участвовало в реакции(100%-1,5%=98,5%):
16005,6 г-100%
х г-98,5 %
Из пропорции: х=16005,6г*98,5%/100%=15 765,516 г или примерно 15,8 кг
ответ:15 765,516 г или примерно 15,8 кг
2)
а)Напишем уравнение реакции:
FeS+H2SO4(разбав.)===>FeSO4+H2S(стрелка вверх)
Из уравнение можно сделать вывод: v(FeS)=v(FeSO4)
v(FeS)=m/M=320 000 000 г/88г/моль=3636363,6 моль
v(FeS)=v(FeSO4)=3636363,6 моль
m(FeSO4)=M*v=152г/моль*3636363,6 моль=552727267,2 г
б)Узнаем массу сульфата железа(2) без примесей:
552727267,2 г-100%
х г -97%
Из пропорции: х=552727267,2 г*97%/100%=536145449,184 г или примерно 536 тонн
ответ:536145449,184 г или примерно 536 тонн
3)
а)Узнаем сколько чистого в-ва сульфида магния(т.е. без примесей) будет участвовать в реакции(100%-3,8%=96,2%):
25 000 г-100%
х г-96,2%
Из пропрции: х=25 000г*96,2%/100%=24 050 г
б)Напишем уравнение реакции:
MgS+2HCl===>MgCl2+H2S(стрелка вверх)
Из уравнения реакции можно сделать вывод: v(MgS)=v(H2S)
v(MgS)=m/M=24 050 г/56г/моль=429,5 моль
v(MgS)=v(H2S)=429,5 моль
V(H2S)=v*Vm=429,5 моль*22,4л/моль=9620,8 л
ответ:V(H2S)=9620,8 л