A11 - 2, т.к. в ходе р-ии выделится водород. В 1 случае не происходит ни выпадение осадка, ни выделение газа, ни образование малодиссоциирующего в-ва, в 3 и 4 случаях р-я не протекает, т.к. к-ты не реагируют с оксидами и металлами, идущими в ряду активности после водорода.
А12 - 4, т.к. BaSO4, Al(OH)3 выпадают в осадок. В 1 и 3 случае не вступит в р-ю с HCl, во 2 - с NaCl, т.к. не произойдет ни выпадение осадка, ни выделение газа, ни образование малодиссоциирующего в-ва.
А-15 - 3, т.к. w=M(Cu)/M(Cu(OH)2)*100%=65,3%
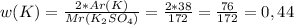 или 44%
или 44%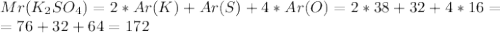
Гидролиз крахмала:
(C6H10O5)n + nH2O -> nC6H12O6 - глюкоза
***
Если более узко рассматривать продукты гидролиза крахмала, то вот они:
(C6H10O5)n -> (вода, кислоты) -> растворимый крахмал
-> (C6H10O5)x - декстрины -> n/2C12H22O12 - мальтоза -> nC6H12O6 - глюкоза
***
Гидролиз по катиону Железа 3+, - слабое основание, сильная кислота, к примеру хлороводород.
1 ст. Fe3+ + H(+)OH(-) -> Fe(OH)2(+) + H+ < катион водорода, среда кислая
FeCl3 + 2HOH -> Fe(OH)2Cl + 2HCl
2ст. Fe(OH)2(2+) + H(+)OH(-) = Fe(OH)3 + H(+) < катион водорода, среда кислая
Fe(OH)2Cl + HOH = Fe(OH)3 + HCl
Гидролиз по силикат - аниону SiO3(2-) - слабая кислота, сильное основание, возьмем например силикат натрия Na2SiO3
1ст. SiO3(2-) + H(+)OH(-) = HSiO3(-) + OH(-) < гидроксид - ионы, щелочная
Na2SiO3 + HOH = NaHSiO3 + NaOH
2ст. HSiO3(-) + H2O = H2SiO3(осад.) + OH(-) <--- гидроксид - ионы, среда щелочная
NaHSiO3 + H2O = H2SiO3 + NaOH