20 г
Объяснение:
Напишем взаимодействие оксида серы с водой (в будущем это нам пригодится)
SO₃ + H₂O = H₂SO₄
Считаем массу начального раствора
m(раствора) = ρ * V(раствора) = 1.8 * 55.6 = 100 г
Считаем массу кислоты в нем
m(H₂SO₄) = w * m(раствора) = 0.91 * 100 = 91 г
Пусть количество вещества поглощенного оксида серы х моль. Тогда его масса 80х г. Масса образовавшейся кислоты 98х г. Такие выводы мы сделали из уравнения химической реакции Подставим все это в формулу
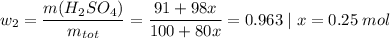
Ну и посчитаем массу оксида серы
m(SO₃) = M(SO₃) * n(SO₃) = 80 * 0.25 = 20 г
3*CuCL2 + 2*AL = 2*ALCL3 + 3*Cu
Находим массу сухого веществ CuCL2 = 0.08*270.
Делим её на молярную массу CuCl2 - получаем количество молей CuCl2 = k
Делим массу AL - 3.24г на молярную массу AL - получишь кол-во молей алюминия = m.
И сравниваешь теперь соотношение
3 моль CuCl2 - 2 моль AL
k моль CuCL2 - m моль AL
Если m меньше 2/3 k, то алюминия не хватит и наоборот!