200 грамм
Объяснение:
CH ≡ CH + 2Br2 → CHBr2 — CHBr2
v(C2H2) = 0.448 л
n(C2H2) = 0.448 : 22.4 = 0.02 моль
По реакции моли ацетилена и брома относятся как 1 к 2, а по задаче мы выяснили, что 0.02 моль ацетилена вступают в реакцию с X молями брома. Из этого следует, что :
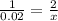
x= 0.04 моль Br2 реагирует с 0.02 молями C2H2
n(Br2) = 0.04 моль
m(Br2) = 0.04 × 160 = 6.4 грамм Br2.
Теперь переходим к раствору
w(р-ра) = 3.2% или 3.2 ÷ 100= 0.032 это массовая доля
m1(Br2) = 6.4 грамм
m(р-ра) = Х
Составляем уравнение:
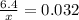
x= 200 грамм
Значит для обесцвечивания ацетилена объемом 0.448 литром, нам понадобилось 200 грамм 3.2% раствора бромной воды
Если будут вопросы, то можете отписать в комментариях.
Дано:
m (смеси) = 40 г ;
n (H₂O) = 0,2 моль.
Найти:
ω (NaOH) — ?
Cu(OH)₂ = (t°) CuO + H₂O.
По уравнению реакции видим, что n (H₂O) = n Cu(OH)₂ = 0,2 (моль).
Найдём молярную массу Cu(OH)₂.
M (Cu(OH)₂) = 64 + 2 · 17 = 98 (г/моль).
Найдём массу Cu(OH)₂ по формуле: m = n · M; где: m - масса (г), n - количество вещества (моль), M - молярная масса (г/моль).
m (Cu(OH)₂) = 0,2 моль · 98 г/моль = 19,6 (г).
Соответственно, m (NaOH) = 40 г – 19,6 г = 20,4 (г).
Теперь составим пропорцию и узнаем массовую долю гидроксида натрия в смеси.
40 г — 100 %
20,4 г — x %
x = 51 (%).
ответ: 51%.
1) NaH+H2O=NaOH+H2
n(NaH)=24 :24=1моль
По реакции n(H2)=n(NaH)=1моль; m(H2)= 2г; n(NaOH)= 1моль;
m(р-ра )= 24+1000 - m(H2)=24+1000-2=1140 г
2)m(HNO3)р-ра =100*1,18=118г; m(HNO3)в р-ре =118*0,3=35,4г;
Т.е. прилили ещё 118 г и стало 1140+118 = 1258 г раствора
n(HNO3)=35,4 :63=0,56моль;
3)NaOH+HNO3=NaNO3+H2O
Т.к. 1 моль NaOH и 0,56 моль HNO3, то щелочь в избытке:
n(NaOH)избытка =1-0,56=0,44моль;
m(NaOH)=0,44*40=17,6г;
m(NaNO3)=0,56*85=47,6 г
W(NaNO3)=47,6 : 1258 = 0,0378 (3,78%)
W(NaOH)=17,6 : 1258 = 0,014(1,4%)