С Br₂, растворённом в CCl₄, будут реагировать газы, имеющие кратный связи, то есть C₂H₄ и C₃H₆.
Найдём молярную массу смеси. M=1.546*28=43.288 г/моль
n(смеси)=0.625 моль
m(Br₂)=320*0.2=64 г
n(Br₂)=0.4 моль
Запишем реакции:
C₂H₄+Br₂=C₂H₄Br₂
C₃H₆+Br₂=C₃H₆Br₂
Если количество смеси 0.625 моль, а прореагировавшего брома 0.4 моль.. делаем вывод, что количество бутана 0.225 моль.
n(C₄H₁₀)=0.225 моль; φ(C₄H₁₀)=0.225/0.625=0.36 или 36%
M(оставшейся смеси)=43.228-M(C₄H₁₀)*0.36=43.228-20.88=22.348 г/моль
Пусть φ(C₂H₄)=x, значит φ(C₃H₆)=0.64-x
22.348=28x+26.88-42x
4.532=14x
x=0.324
φ(C₂H₄)=32.4%
φ(C₃H₆)=31.6%
ответ: φ(C₃H₆)=31.6%; φ(C₂H₄)=32.4%; φ(C₄H₁₀)=36%.
1) S --> P ---> Al --> Mg
металлические св-ва увеличиваются в периодах справа налево, так уменьшается число внешних электронов и атом их легче отдает
2) ²⁴Mg(12,12e,12n)
на внешнем уровне - 2е
число электронных слоёв - 3
¹²C(6p,6e,6n)
на внешнем уровне - 4е
число электронных слоёв - 2
³²S(16p, 16e, 16n)
на внешнем уровне - 6е
число электронных слоёв - 3
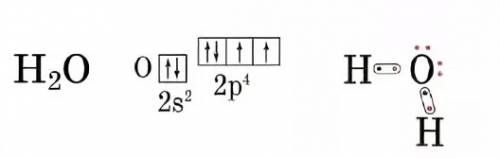
3) ковалентно-полярная связь: H2O, SО3
Fe2О3(ионная), NaCl(ионная) CaO(ионная), ,Н2(ковалентно-неполярная)
схема в фото
4) Ar(Si) = 28
IV группа, главная подгруппа, 3 малый период. 3 ряд
+14 ) ) )
2 8 4
1s² 2s² 2p⁶ 3s² 3p² -электронная формула
5)
Mr(Fe₂O₃) = 56*2+16*3 = 160
w(O) = Ar(O)*n(O)\Mr(Fe₂O₃) = 16*3\160 = 0,3 , или 30%
Al2(SO4)3 + 6NaOH(изб)→2Al(OH)3+3Na2SO4
AL+3OH=Al(OH)3