F2+NaOH->NaF+OF2+H20 ОВР
Расставить заряды элементов.
F -, при реакции в OF2 F+ положительный заряд, А при NaF , F -.
то есть фтор является элементом, и отдающим электроды, и забирающим...
Давно это было. Сложно очень подробно обьяснить.
нет
Объяснение:
Они могут проявлять и окислительные св-ва
Окислительные свойства неметаллов проявляются при их взаимодействии:
с металлами:
Подгруппа углерода (IV):
Общая схема реакций:
Me+C → карбиды;
Me+Si → силициды
Примеры:
4Al0+3C0=Al4+3C3-4
Подгруппа азота (V):
Общая схема реакций:
Me+N → нитриды;
Me+P → фосфиды
Примеры:
2Al0+N20=2Al+3N-3
Халькогены(VI):
Общая схема реакций:
Me+O2 → оксиды;
Me+S → сульфиды
Me+Se → селениды;
Me+Te → теллуриды
Примеры:
4Al0+3O20=2Al2+3O3-2
Галогены (VII):
Общая схема реакций:
Me+F2 → фториды;
Me+Cl2 → хлориды
Me+Br2 → бромиды;
Me+I2 → йодиды
Примеры:
2Al0+3F20=2Al+3F3-1
с водородом с образованием летучих водородных соединений:
H20+S0 ↔ H2+1S-2 - сероводород
H20+Cl20 ↔ 2H+1Cl-1 - хлороводород
3H20+N20 ↔ 2N-3H3+1 - аммиак
с другими неметаллами, у которых более низкая электроотрицательность (см. таблицу электроотрицательности) - фтор самый сильный окислитель из всех неметаллов, т.к. имеет самую высокую электроотрицательность:
2P0+5S0=P2+5S5-2
H20+F20=2H+1F-1
с некоторыми сложными веществами:
кислород при взаимодействии со сложными веществами выступает в роли окислителя:
C-4H4+2O20 → C+4O2-2+2H2O-2;
2S+4O2+O20 → 2S+6O3-2
хлор окисляет хлорид железа (II в III):
2Fe+2Cl2-1+Cl20 = 2Fe+3Cl3-1
хлор вытесняет йод в свободном виде из раствора йодида калия:
2K+1I-1+Cl20 = K+1Cl-1+I20
реакция галогенирования метана:
C-4H4+Cl20 → C-2H3Cl-1+HCl-1
2
Объяснение:
O
||
H2C - CH2 - CH2 - CH2 - CH2 - C - OH + такая же кислота →
|
NH2
O O
|| ||
H2C - CH2 - CH2 - CH2 - CH2 - C - NH - H2C - CH2 - CH2 -CH2-CH2-C-OH
|
NH2
+ H2O
Здесь у нас довольно необычная ОВР - два сильнейших окислителя - кислород и фтор. Но все - таки, кислород будет восстановителем, ибо фтор ни при каких условия не будет таковым.
Запишем данную реакцию вместе со степенями окисления:
Запишем реакции окисления и восстановления. Окисляться у нас будет кислород, так как степень окисления у него растет от -2 до +2(во фториде ), запишем этот процесс:
Теперь со фтором. Фтор - самый сильный - ПЕРВЫЙ окислитель, у никогда не будет положительной степени окисления. В этой реакции его СО изменяется от 0 до -1. Запишем этот переход:
Теперь распишем переходы электронов для каждого процесса:
Для Фтора:
Для Кислорода:
Теперь нам надо, чтобы количество оттданых элетронов(т.е. число электронов которые отдал кислород) равнялось количеству принятых электронов(т.е. тех которые принял фтор). Кислород отда - 4 электрона, а фтор принял только - 2, значит уравнение восстановления фтора умножаем на два:
Теперь мы суммируем, т.е. записываем в систему два полученных уравнения с кислородом и со фтором:
Та двойка которая получилась перед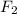 и та 4 которая получилась
и та 4 которая получилась 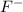 перед - это коэффициенты - выносим их в левую часть получим:
перед - это коэффициенты - выносим их в левую часть получим:
Понятно???